
【题目】下列各组物质之间的化学反应,反应产物一定为纯净物的是( )
A. 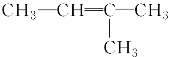 ―→
―→
B. CH2===CH—CH2—CH3+HCl![]()
C. CH3—CH===CH2+H2O![]()
D. nCH2===CH2+nCH2===CH—CH3![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D 4种短周期元素的原子序数依次增大。A、D同族;B、C同周期。A、B组成的化合物甲为气态,其中A、B原子个数之比为4:1。常温下,由A、C组成的两种化合物乙和丙都为液态,乙中A、C原子个数比为1:1;丙中A、C原子个数比为2:1。由D和C组成的两种化合物丁和戊都为固态,丁中D、C原子个数之比为1:1;戊中D、C个数比为2:1。B元素的最高价氧化物跟丁能发生化学反应,生成物为两种,其中一种为C的单质。
(1)写出对应物质的化学式①乙_______;②丁_______。
(2)B元素的最高价氧化物跟丁反应的化学方程式_______。
(3)写出下列物质的电子式①甲_______;②戊_______。
(4)A、B、C、D4种原子的半径由大到小顺序______(填元素符号)。
(5)由A、B、C、D4种原子组成的既含离子键又含共价键的物质的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Ca、Cu、Fe 四种金属元素组成,回答下列问题:
(1)基态Fe原子有_______个未成对电子,Fe3+的价电子排布式为__________。
(2)新制的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙醛分子中含有的σ键与π键的比例为___。乙醛中碳原子的杂化轨道类型为_____,配合物[Cu(NH3)4](OH)2中含有的化学键类型有_________,1 mol该物质中有______个σ键。
(3)Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______个铜原子。
(4)CaCl2熔点高于AlCl3的原因__________________________________。
(5)CaF2晶胞如图所示,已知:氟化钙晶体密度为ρg·cm-3,NA代表阿伏加德罗常数的值。氟化钙晶体中Ca2+和F-之间最近核间距(d)为______________pm(只要求列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化SO2。下列说法正确的是

A. 每活化一个氧分子吸收0.29eV能量
B. 水可使氧分子活化反应的活化能降低0.42eV
C. 氧分子的活化是O-O的断裂与C-O键的生成过程
D. 炭黑颗粒是大气中SO2转化为SO3的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是异辛烷的球棍模型:

(1)根据球棍模型,写出异辛烷的结构简式:________;异辛烷与乙烷的关系是__________。
(2)写出异辛烷完全燃烧的化学方程式:______________________ (异辛烷用分子式表示)。1 mol异辛烷和1 mol正庚烷分别完全燃烧生成水和二氧化碳,消耗氧气的物质的量之差是___mol。
(3)异辛烷的同分异构体有很多,其中一种同分异构体X的分子结构中含有6个甲基,则X的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类发现最早并广泛使用的一种金属。回答下列问题:
(1)实验室使用稀硫酸和H2O2溶解铜片,该反应的化学方程式为__________________。
(2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,写出该过程的离子方程式____________。配制的FeCl3溶液应保持_______(填“酸性”“碱性”或“中性”),原因是_____________。
(3)溶液中Cu2+的浓度可采用碘量法测得:
①2Cu2++5I―=2CuI↓+I3- ②I3- +2S2O32-=3I―+2S2O62-
反应①中的氧化剂为_____________。现取20.00 mL含Cu2+的溶液,加入足量KI充分反应后,用0.1000 mol·L1 Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液25.00 mL,此溶液中Cu2+的浓度为_______mol·L1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物都是形成雾霾天气的重要因素。下列方法可处理氮氧化物和硫氧化物。
(1) 用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,在一定条件下,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=Q kJ/mol。
N2(g)+CO2(g) ΔH=Q kJ/mol。
在T1℃时,反应进行到不同时间测得各物质的浓度如下表。
时间/min 浓度/mol/L | 0 | 10 | 20 | 30 |
NO | 1.00 | 0.58 | 0.40 | 0.40 |
N2 | 0 | 0.21 | 0.30 | 0.30 |
CO2 | 0 | 0.21 | 0.30 | 0.30 |
①0~10 min内,NO的平均反应速率v(NO)=_____________,T1℃时,该反应的平衡常数K= _____________。
②若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2∶1∶1,则Q_____________ (填“>”、“=”或“<”) 0。
(2) NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图甲所示。

①由图甲可知,SCR技术中的氧化剂为_____________。已知 NH3氧化时发生如下反应:
4NH3(g)+5O2(g) = 4NO(g)+6H2O(g) ΔH1=-907.28 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH2=-1811.63kJ·mol-1
则氨气被氧化为氮气和水蒸气的热化学方程式:_______________________
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业选取的最佳催化剂及相应的温度分别为___________、___________。
(3) 烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,若所得溶液呈中性,则该溶液中c(Na+)=__________________(用含硫微粒浓度的代数式表示)。
(4) 某研究小组用NaOH溶液吸收二氧化硫后,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图丙所示,电极材料为石墨。

丙
①a表示_______(填“阴”或“阳”)膜。A-E分别代表原料或产品,其中C为稀硫酸,则A为____________溶液(填写化学式)。
②阳极电极反应式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示转化关系(部分产物已略去)。下列说法正确的是
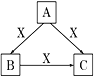
A. 若X为O2,则A可为有机物乙醇,也可为非金属单质硫
B. 若X为KOH溶液,则A可能为Al
C. 若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2
D. 若X为Fe,则C可能为Fe(NO3)2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com