
化学肥料在农业生产中具有重要的作用,关系着农业生产是否丰收。化学肥料在农业生产中的广泛应用,为化学肥料的大规模工业生产提供了舞台。
(1)在合成氨的设备(合成塔)中,设置热交换器的目的是______________。
(2)生产硝酸的过程中常会产生一些氮的氧化物,一般可采用下列两种方法处理。
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
氨还原法:8NH3+6NO2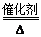 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
请从绿色化学的角度分析两种方法的优劣:____________________。
(3)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%,NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗用NH3质量(不考虑其他损耗)的________%。
(4)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表(填两条应注意的事项及理由即可)。
| | 注意事项 | 理由 |
| ① | ______________ | ____________ |
| ② | ________________ | ____________ |
(1)利用余热,节约能源
(2)碱液吸收法要消耗大量的NaOH,同时产生有毒的NaNO2,但可以生产副产品“工业盐(NaNO2)”;氨还原法不消耗贵重原料,且产物无污染,但氮的氧化物被浪费了
(3)53.1
(4)①不能与碱性肥料混施 硝酸铵溶液呈酸性 ②不能剧烈撞击 硝酸铵易爆炸 ③不能在雨水较多的地区使用 硝酸铵吸水性强,易流失(答出任意两条即可)
解析试题分析:(1)热交换器可以把合成氨时放出的热量转移出来,既降低了反应体系的温度,又能使余热得以充分利用。
(2)氮的氧化物的“碱液吸收法”和“氨还原法”各有优劣,前者消耗烧碱,且产物有毒,但可生产“工业盐”;后者消耗氨气,产物无毒,但使氮的氧化物白白浪费。
(3)硝酸铵中硝态氮和铵态氮的量相等,但由氨气生产硝态氮的过程中出现了损失,假设硝酸铵中硝态氨和铵态氮各为1,则生产硝态氮需要的氨为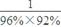 =1.13,所以制HNO3所用去的NH3的质量点总耗用NH3质量的百分比为
=1.13,所以制HNO3所用去的NH3的质量点总耗用NH3质量的百分比为 =53.1%。
=53.1%。
(4)①硝酸铵为强酸弱碱盐,水解显酸性,,所以不能与碱性肥料混施。
②硝酸铵撞击时分解,容易爆炸,所以不能剧烈撞击;硝酸铵吸水性强,易流失,所以不能在雨水较多的地区使用。
考点:本题考查化学工艺的分析、原料用量的计算。


科目:高中化学 来源: 题型:填空题
请从图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。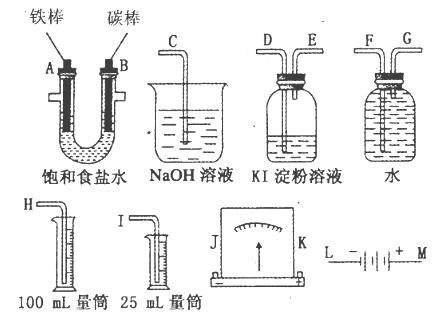
(1)A极发生的电极反应式是_____________________·B极发生的电极反应式是_______________________;电解饱和食盐水的化学方程式是______________________。
(2)电源的M端应连接的电极为____________(A或B)极。
(3)设计上述气体实验装置时,各接口的正确连接顺序为:______________________________
__________________________________(填接口编号)。
(4)实验中,在盛有KI淀粉溶液的容器中发生反应的离子方程式为________________。
(5)已知饱和食盐水50mL,某时刻测得H2体积为56mL(标准状况)。此时溶液pH约为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氨气是一种重要的工业产品,也是一种重要的化工原料。为研究氨气的制备及性质,某学习小组进行了下面的探究活动:
(1)实验室中往往采用熟石灰与氯化铵制备氨气,写出该反应的化学方程式(注明反应条件)___________________________________________________________。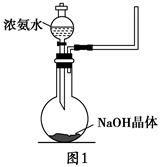
(2)实验室中还可以采用如图1装置(略去了夹持装置)和药品快速制备氨气:
①甲同学不明白该方法中制备氨气的原理,于是学习小组内成员展开了讨论,得出了下面的结论,其中不正确的是________(填字母序号)。
a.氨水中的NH3·H2O分解
b.氨水中存在可逆反应:NH3·H2O NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
c.反应原理与铵盐、熟石灰制备氨气的反应原理相同
d.NaOH溶于水放出热量,使NH3·H2O分解
②乙同学取质量分数为34%的0.89 g·mL-1的浓氨水10 mL,用过量的NaOH与之混合,然后用500 mL的烧瓶收集氨气。请你计算最多可收集满标准状况下的氨气________个烧瓶。
(3)丙同学进行氨气的喷泉实验探究。
①收集氨气时需要用干燥剂干燥,如图2,装置B中盛装的干燥剂是________。
②该同学利用图3装置,成功地完成了喷泉实验。请你简要地写出该同学操作的正确方法:__________________________________________________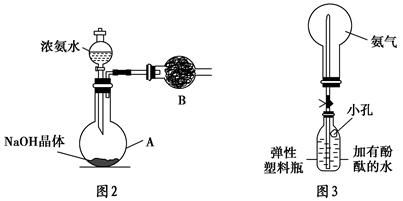
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0)。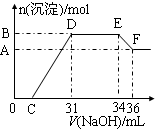
试回答下列问题:
(1)写出反应过程中DE段的离子反应方程式: ,EF段生成含氧元素离子的名称是 。
(2)合金中铁的质量为 g 。
(3)C的值为 mL。
(4)硝酸溶液的物质的量浓度为 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
SO2是一种重要的化工原料,也是一种环境污染物。
(1)SO2可用于工业制Br2过程中吸收潮湿空气中的Br2,反应的离子方程式是 。
(2)直接排放含SO2的烟气会形成酸雨,危害环境。用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(3)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol?L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
①此时溶液中c(SO32-)的浓度是0.2 mol?L-1,则溶液中c(HSO3-)是_________mol?L-1,由此说明NaHSO3溶液显 性,用化学平衡原理解释: 。
②向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸。
(1)工业上用水吸收NO2生产HNO3,生成的气体经多次氧化、吸收的循环操作充分转化为硝酸(假定上述过程无其他损失)。试写出上述反应的化学方程式:
______________________________________________________________。
(2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置已略去)。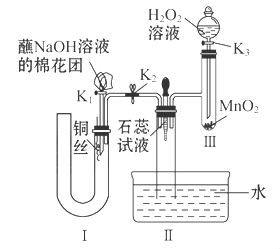
①检查装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入稀硝酸至 后,迅速关闭K1,观察到U形管内的现象是____________________________________________________。
②装置Ⅲ中发生反应的化学方程式为_______________________________。
③蘸NaOH溶液的棉花团的作用是___________________________________。
④打开K2,至装置Ⅱ中长玻璃管中的气体呈无色后,打开K3,反应一段时间后,长玻璃管中并未充满液体。设计简单方法检验长玻璃管中的气体是否含NO__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
标准状况,体积相同的四支试管中分别盛满Cl2、NH3、SO2和NO2,分别倒立在盛有足量水的水槽中(假设进入试管的液体不扩散),光照充分溶解。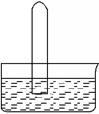
(1)从物质分类的角度可以推测物质的性质。其中SO2属于_______氧化物(填“酸性”、“碱性”或“两性”)。
SO2 + ( ) → 含氧酸盐。
SO2 + ( ) → 盐 + ( )。
(2)装有NO2的试管倒立在盛有足量水的水槽时,反应的化学方程式为___________________。实验现象为______________________________________________________________________。
(3)装有NH3的试管进行实验时,实验完毕试管内溶液的物质的量浓度为 。
(4)装有Cl2的试管倒立在盛有足量水的水槽中经过充分的光照,实验结束试管中剩余的气体是 ,生成该气体先后发生的化学方程式有 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D为中学化学四种常见物质,A为红棕色气体,它们之间的相互转化关系如右图。已知:A+H2O→M+C;D+H2O→N,M、N是酸雨的主要成分。
(1)写出下列反应化学方程式
①A+H2O→M+C 。
②A+B→C+D 。
(2)下列哪些物质不能与N的浓溶液反应 。
a.NH3 b.H2 c.SO2 d.H2S
(3)下列实验方案可以用于在实验室制取B的是 。
a.Na2SO3溶液与HNO3 b.Na2SO3固体与浓硫酸
c.固体硫在纯氧中燃烧 d.铜与浓H2SO4加热
(4)某同学认为:将A通入到Na2S溶液中能够证明A的氧化性,此说法是否正确 (填“是”或“否”),请说明理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)Ca(ClO)2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有__________性,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式____________________。
(2)棕黄色强刺激性气体Cl2O为国际公认高效安全灭菌消毒剂之一,实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,配平并补充完整下列反应方程式:
______Cl2+_______Na2CO3+________=_______NaHCO3+____NaCl+____ Cl2O
(3)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为__________。
②ClO2遇浓盐酸会生成Cl2,每生成1mol Cl2转移电子的物质的量为__________。
③ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为_________________。
(4)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应4HCl+O2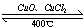 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
已知:①上述反应中,4mol HCl被氧化放出115.6kJ的热量。
②
则断开1 mol H-O键与断开1 mol H-Cl键所需能量相差约为_________kJ,H2O中
H—O键比HC1中H—Cl键(填“强”或“弱”)__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com