
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
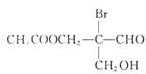 有机物若含手性碳原子(连接四个不同的原子或原子团的碳原子)就具有光学活性,如图物质发生下列反应后生成的有机物仍有光学活性的是( )
有机物若含手性碳原子(连接四个不同的原子或原子团的碳原子)就具有光学活性,如图物质发生下列反应后生成的有机物仍有光学活性的是( )| A、仅③ | B、仅①③ |
| C、仅②④⑤ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在AgBr饱和溶液中加入AgNO3溶液,达到平衡时,溶液中Br-浓度降低 |
| B、常温下,某溶液中由水电离出的c(OH-)=1×10-10mol/L,该溶液一定呈酸性 |
| C、FeCl3溶液和Fe2(SO4)3溶液加热蒸干,灼烧都得到Fe2O3 |
| D、向饱和碳酸钠溶液中通入足量二氧化碳,可以析出纯碱晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com