
【题目】地球表面十公里厚的地层中,含钛元素达千分之六,比铜多61倍,金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值。氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。以TiCl4为原料,经过一系,列反应可以制得Ti3N4和纳米TiO2(如下图)。

图中的M是短周期金属元素,M的部分电离能如下表:
I1 | I2 | I3 | I4 | I5 | |
电离能/(kJ·mol-1) | 738 | 1451 | 7733 | 10 540 | 13 630 |
请回答下列问题:
⑴TiO2为离子晶体,己知晶体中阳离子的配位数为6,阴离子的配位数为3,则阳离子的电子排布式为___________
⑵金属Ti与金属M的晶体原子堆积模式相同,其堆积模型为_________(填写堆积模型名称),晶体中原子在二维平面里的配位数为_____________
⑶室温下TiCl4为无色液体,沸点为136.4℃,由此可知其晶体类型为__________,构成该晶体的粒子的空间构型为_____________
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如下图所示,已知该氮化钛的密度为pg·cm-3,则该晶胞中N、Ti之间的最近距离为_____ pm,(NA为阿伏加德常数的数值,只列算式)。该晶体中与Ti原子距离相等且最近的Ti原子有___________个。

(5)科学家通过X射线探明KC1、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据如下:
离子晶体 | NaCl | KC1 | CaO |
晶格能/(kJ·mol-1) | 786 | 715 | 3401 |
KC1、CaO、TiN三种离子晶体硬度由低到该的顺序为_____________
【答案】 1s22s22p63s23p6 六方最密堆积 6 分子晶体 正四面体 ![]() 12 KCl<CaO<TiN
12 KCl<CaO<TiN
【解析】本题考查选修三《物质结构与性质》,从基础知识入手,(1)Ti是阳离子,Ti是22号元素,因此Ti4+的电子排布式为:1s22s22p63s23p6;(2)根据金属M的电离能,在第二电离能到第三电离能发生突变,说明最外层有2个电子,M是短周期金属元素,根据部分电离能,推出是Mg,金属Ti与Mg的晶体原子堆积模式相同,因此堆积模式为六方最密堆积,二维平面里的配位数为6;(3)TiCl4为无色液体,且沸点较低,符合分子晶体的特点,因此TiCl4属于分子晶体,空间构型为正四面体;(4)根据晶胞的结构,最近N和Ti的位置是棱长的一半,设棱长为apm,晶胞中Ti位于棱上和体心,个数为12×1/4+1=4,N位于面心和顶点,个数为8×1/8+6×1/2=4,化学式为TiN,晶胞的质量为4×62/NAg,晶胞的体积为(a×10-10)3cm3,根据密度的定义求的Ti和N的最近距离是![]() ,根据晶胞的结构,距离Ti最近的Ti上面有四个,同一平面的有4个,下面有4个,共有12个;(5)晶格能越大,硬度越大,晶格能与阴阳离子所带电荷数以及阴阳离子的半径有关,所带电荷数越多,半径越小,晶格能越大,硬度越大,即KCl<CaO<TiN。
,根据晶胞的结构,距离Ti最近的Ti上面有四个,同一平面的有4个,下面有4个,共有12个;(5)晶格能越大,硬度越大,晶格能与阴阳离子所带电荷数以及阴阳离子的半径有关,所带电荷数越多,半径越小,晶格能越大,硬度越大,即KCl<CaO<TiN。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列实验所采取的方法正确的是
A. 除去苯中的苯酚,加入溴水后过滤 B. 除去硝基苯中的NO2,加入NaOH溶液后分液
C. 分离苯和溴苯,加水后分液 D. 可用分液漏斗将甘油和水的混合液体分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)=CO2(g) ΔH1
CO2(g)+C(s)=2CO(g) ΔH2
2CO(g)+O2(g)=2CO2(g) ΔH3
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是( )
A.ΔH1>0,ΔH3<0 B.ΔH2>0,ΔH4>0
C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+ΔH5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确是( )
①生成物的质量分数一定增加
②生成物的产量一定增大
③反应物的转化率一定增大
④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率
⑥平衡常数一定增大
A.①② B.③⑤ C.②⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1
FeO(s)+CO(g) ΔH1,平衡常数为K1
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2在不同温度时K1、K2的值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH,平衡常数K,则ΔH=___________(用ΔH1和ΔH2表示),K=___________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH,平衡常数K,则ΔH=___________(用ΔH1和ΔH2表示),K=___________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是________反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
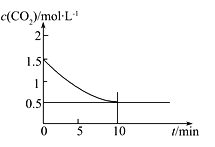
①该条件下反应的平衡常数为___________;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为____________mol·L-1。
②下列措施中能使平衡时![]() 增大的是__________(填序号) 。
增大的是__________(填序号) 。
A.升高温度 B.增大压强 C.再充入一定量的CO2 D.再加入一定量铁粉
③一定温度下,在一个固定容积的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母)。
a.容器中的压强不变
b.气体的密度不再改变
c.v正(CO2)=v逆(CO)
d.c(CO2)=c(CO)
e.容器内气体总物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种最新合成的溶瘤药物,可通过以下方法合成:

⑴F中所含官能团名称为_____________。
⑵A→B的反应类型是_____________。
⑶C的结构简式为_____________。
⑷写出同时满足下列条件的![]() 的一种同分异构体G的结构简式:
的一种同分异构体G的结构简式:
_____________。
①G分子中有4种不同化学环境的氢;
②G的水解产物均能发生银镜反应,其中一种产物还能与FeCl3溶液发生显色反应。
⑸请写出以![]() 、(C6H5)3P为原料制备化合物
、(C6H5)3P为原料制备化合物 的合成路线流程图________(无机试剂任选,合成路线流程图示例见本题题干)。
的合成路线流程图________(无机试剂任选,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:I.反应A中,4molHCl被氧化,放出115.6kJ热量。
II.
判断下列说法正确的是( )
A. 反应A的△H>-115.6kJ·mol-1
B. H2O中H—O键比HCl中H—Cl键弱
C. 由II中的数据判断氯元素的非金属性比氧元素强
D. 断开1molH—O键与断开1molH—Cl键所需能量相差31.9kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用下面所示装置制取氯酸钾、次氯酸钠和氯水并进行探究实验。

实验I.制取氮酸钾、次氯酸钠和氯水
(1)写出装置A实验室制取Cl2的化学反应方程式________________________________。
(2)制取实验结束后,取出装置B中的试管,冷却结晶、过滤、洗涤,该实验操作过程需要的玻璃仪器有胶头滴管、烧杯、_________、_________。为提高氯酸钾和次氯酸钠的产率,在实验装置中还需要改进的是_________。
(3)装置 C 中反应需要在冰水浴中进行,其原因是________________________________。
(4)装置D中的实验现象是溶液先变红后褪色,最后又变为_________色。
实验Ⅱ 尾气处理
实验小组利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(5)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中的CO2的影响)
①提出合理假设
假设1:只存在SO32- ;假设2:既不存在SO32-也不存在ClO-;假设 3:_________。
②设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3mol/L H2SO4、1mol/LNaOH 溶液、0.01mol/L 酸性 KMnO4 溶液、淀粉 KI 溶液。
实验步骤 | 预期现象和结论 |
步骤1:取少量吸收液分置于A、B试管中 | |
步骤2:向A试管中滴加0.01mol/L酸性 | (1)若溶液褪色,则假设1成立 |
KMnO4溶液 | (2)若溶液不褪色,则假设2或3成立 |
步骤3:_____ | _____ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com