
| A. | 该反应中氧化剂与还原剂物质的量之比为3:4 | |
| B. | 该反应中氧化产物与还原产物物质的量之比为1:4 | |
| C. | N是氧化产物,而且是极性分子 | |
| D. | M是还原产物,其还原性比NH3弱 |
分析 氨气和氟气之间发生氧化还原反应,该反应的化学方程式为4NH3+3F2=NF3+3NH4F,反应中N元素化合价升高,F元素化合价降低,氨气表现了还原性,F2为氧化剂,结合元素化合价的变化解答该题.
解答 解:反应的化学方程式为4NH3+3F2=NF3+3NH4F,
A.N元素的化合价升高,F元素的化合价降低,且4molNH3中只有1mol作还原剂,则氧化剂与还原剂物质的量之比为3:1,故A错误;
B.氧化产物为NF3,还原产物为NF3、NH4F,则该反应中氧化产物与还原产物物质的量之比为1:4,故B正确;
C.N为NF3,与氨气结构相似,为极性分子,氧化产物为NF3,故C正确;
D.M为NH4F,为还原产物,由还原剂的还原性大于还原产物的还原性可知,其还原性比NH3弱,故D正确;
故选A.
点评 本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握题给信息,从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,题目难度不大.


科目:高中化学 来源: 题型:填空题
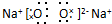 ,甲中的化学键类型为离子键、共价键.
,甲中的化学键类型为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
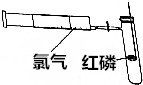 已知SnCl4、SiCl4、AlCl3、PCl3、PCl5等氯化物在潮湿的空气中都有白雾生成.为清楚地观察磷在氯气中燃烧,达到PCl3和PCl5分步生成的目的,可预先把干燥的氯气贮存在100mL的注射器内,再把火柴头大小的红磷置于玻璃燃烧匙上烘干后组成如图所示的装置.
已知SnCl4、SiCl4、AlCl3、PCl3、PCl5等氯化物在潮湿的空气中都有白雾生成.为清楚地观察磷在氯气中燃烧,达到PCl3和PCl5分步生成的目的,可预先把干燥的氯气贮存在100mL的注射器内,再把火柴头大小的红磷置于玻璃燃烧匙上烘干后组成如图所示的装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g氧气(O2)和32g臭氧(O3)所含氧原子数都为2NA | |
| B. | 18g水中所含电子数为8NA | |
| C. | 常温常压下,1 mol氖气原子数为2NA | |
| D. | 常温常压下,111.2L氮气所含氮原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
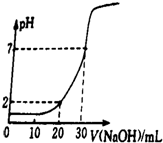 室温下:
室温下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
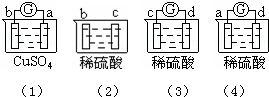
| A. | a>b>c>d | B. | b>c>d>a | C. | d>a>b>c | D. | a>b>d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com