
【题目】将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成如图所示的原电池,下列叙述正确的是

A. KNO3盐桥中的K+移向CuSO4溶液
B. Ag作负极,Cu作正极
C. 工作一段时间后,CuSO4溶液中c(Cu2+)增大
D. 取出盐桥后,电流计的指针依然发生偏转
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,回答下列问题:

(1)表中用于半导体材料的元素在周期表中的位置________________________。
(2)写出短周期金属性最强的元素的离子结构示意图:_____。
(3)③、④、⑤三元素离子半径从大到小的顺序是________________填离子符号)。
(4)②、③、④的气态氢化物,稳定性最强的是_______________填化学式)。
(5)设计实验证明⑤、⑥的金属性强弱__________________________。
(6)在一定条件下,利用置换反应可实现物质之间的转化(仅限于①-⑨中涉及的元素)
①同族元素之间,则反应可能为_____________。
②不同族元素之间,则反应可能为_____________(以上反应各写一条化学方程式即可)。
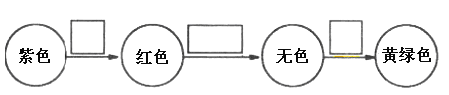
(7)将⑨的单质通入石蕊溶液中发生的颜色变化如下图,请在方框内填写出导致该阶段颜色变化的主要粒子符号。_____________、_____________、_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJmol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJmol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJmol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJmol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)== ![]() CH3OCH3(g)+
CH3OCH3(g)+ ![]() H2O(1)的ΔH =
H2O(1)的ΔH =![]() kJmol-1
kJmol-1
D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在进行化学实验时,经常会有与预期不符的现象出现。某化学实验小组在实验室进行铁盐与亚铁盐相互转化的实验,就出现了与预设不太一致的现象。
实验I:将Fe3+转化为Fe2+
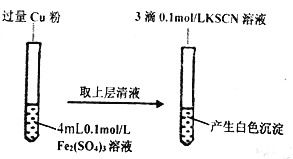
(1)Fe3+与Cu粉发生反应的离子方程式为_________________________________。
(2)该小组同学用对比实验法探究白色沉淀产生的原因,请将其方案补充完整:
实验方案 | 现象 | 结论 |
步骤1:取4mL_________mol/ L CuSO4溶液,向其中滴加3滴0.1mo/ L KSCN溶液 | 产生白色沉淀 | Cu SO4与KSCN反应产生了白色沉淀 |
步骤2:取4mL0.2mol/ L FeSO4溶液,向其中滴加3滴0.1mol/ L KSCN溶液 | ___________ |
查阅资料:①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
③(SCN)2的化学性质与I2相似
则Cu2+与SCN-反应的离子方程式为____________________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/L FeSO4溶液中加入lmL8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色) ②Fe(NO)2+与HNO3不反应
Fe(NO)2+(棕色) ②Fe(NO)2+与HNO3不反应
(3)用离子方程式解释NO产生的原因____________________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应I:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应I的速率比反应Ⅱ___________(填“快”或“慢”)。
②乙认为反应I是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是_______________________________________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因______________________。
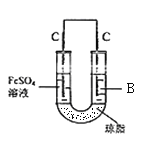
(5)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,他利用实验室常用的仪器和药品设计并完成了如图所示的实验,实现了Fe2+![]() Fe3+的转化,同时避免出现此异常现象。实验发现:U形管右侧有气泡,U形管左侧的现象为___________、B溶液是___________溶液(填化学式)。
Fe3+的转化,同时避免出现此异常现象。实验发现:U形管右侧有气泡,U形管左侧的现象为___________、B溶液是___________溶液(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一个充满CO2的铝制易拉罐中加入适量的NaOH溶液,并密封,易拉罐会慢慢变瘪,原因是____________(用化学方程式表示,下同)后又慢慢鼓起来,原因是________________。
(2)写出还原铁粉与水蒸气反应的化学方程式_____________________。
(3)实验室用碳酸钙与盐酸反应制取CO2气体,反应的离子方程式:___________;常用澄清石灰水检验CO2气体的离子方程式是__________________________________。将表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,开始反应的离子方程式是________________________________;反应片刻后,可观察到有气体产生,其离子方程式是________________________。
(4)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。
①用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为___________________________________________。
②如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3],反应的离子方程式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,下列说法正确的是
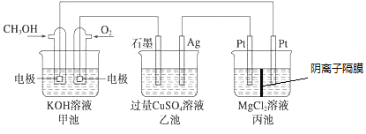
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使溶液恢复原浓度
D. 甲池中消耗4.48L(标准状况下)O2,此时丙池中理论上最多产生23.2 g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某手机电池采用了石墨烯电池,可充电5分钟,通话2小时。一种石墨烯锂硫电池(2Li+S8=Li2S8)工作原理示意图如图,已知参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量。下列有关该电池说法不正确的是( )

A.金属锂是所有金属中比能量最高的电极材料
B.B电极为该电源的负极,发生还原反应
C.A电极的反应:Li-e-=Li+
D.电子从A电极经过外电路流向B电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化石燃料是有机物的重要来源,从煤和石油获取的有机物苯和乙烯等简单有机物还是合成其他有机物的原料。如图的转化关系中,已知C能使碳酸钠溶液释放出CO2,反应①②反应机理类似且原子利用率均为100%,请回答下列问题:

(1)有机物A中含有的官能团名称是_________________。
(2)反应④的反应类型为_________________。
(3)请设计一种能验证B与C混合物中是否含物质B的实验方法_________________。
(4)下列说法正确的是_________________。
A.乙烯与氧气在催化剂作用下反应也可以生成C
B.纯C在16.6℃ 以下呈冰状固体
C.在制备D时,D中常混有一些挥发出来的反应物,可以通过加入NaOH溶液振荡再分液的方法提纯
D.石油裂解气通过净化和分离也能得到丙烯这样的短链烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)① NH3 ②SO3 ③ Cl2 ④ BaSO4 ⑤酒精⑥ CH3COONH4 ⑦HClO⑧Cu,以上物质中 属于非电解质的是___________,属于强电解质的是___________(填入编号)
(2)已知醋酸和盐酸是极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+。
①下列方法中,可以使 0.1mol/CH3COOH的电离程度增大的是___________。
a. 加入少量 0.1mol/L的稀盐酸 b. 加入少量 0.1mol/LCH3COOH
c. 加水稀释至 0.01mol/L d. 加入少量冰醋酸
e. 加入少量醋酸钠固体 f. 加入少量 0.1mol/L的NaOH溶液
②常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是___________(填“A”或“B”)。设盐酸中加入的Zn粒质量为m1,醋酸溶液中加入的Zn粒质量为m2,则m1___________m2(填“<”、“=”、“>”)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com