
【题目】如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,下列说法正确的是
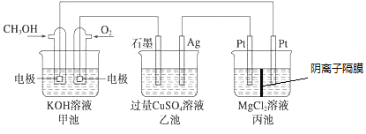
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使溶液恢复原浓度
D. 甲池中消耗4.48L(标准状况下)O2,此时丙池中理论上最多产生23.2 g固体
【答案】D
【解析】
A.甲池是燃料电池,是化学能转化为电能的装置,乙,丙是电解池是将电能转化为化学能的装置。故A错误;
B.甲池通入CH3OH的电极为负极,甲醇失电子发生氧化反应,在碱性电解质下的电极反应为:CH3OH-6e-+2H2O+8OH-=CO32-+8H2O,故B错误。
C.电解池乙池中,电解后生成硫酸,铜与氧气,要想复原,需要加入氧化铜,故C错误;
D.甲池中根据电极反应:O2+2H2O+4e-=4OH-,消耗4.48L(标况下为0.2mol)O2则转移0.8mol电子,根据丙装置中,阴极的电极反应为:2H2O+2e-+Mg2+=Mg(OH)2,由电子守恒可得理论上最多生成氢氧化镁0.4mol×58g/mol=23.2g,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】稀土是一种重要的战略资源。氟碳铈矿主要化学成分为CeFCO3,它是提取铈等稀土元素的重要矿物原料。氟碳铈矿的冶炼工艺流程如下:
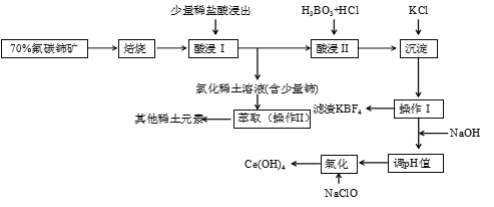
已知:i.铈的常见化合价为+3、+4。焙烧后铈元素转化成CeO2和CeF4。四价铈不易进入溶液,而三价稀土元素易进入溶液。
ii.酸浸II中发生反应:
9CeO2 + 3CeF4 + 45HCl + 3H3BO3 = Ce(BF4)3↓+ 11CeCl3 + 6Cl2↑+ 27H2O
请回答下列问题:
(1)①焙烧氟碳铈矿的目的是______________________________________。
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:___________________________________________。
CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:___________________________________________。
(2)在酸浸I中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。少量铈进入稀土溶液发生反应的离子方程式是_________________________________________________________
(3)向Ce(BF4)3中加入KCl溶液的目的是_____________________________________。
(4)操作I的名称为__________,在实验室中进行操作II时所需要的硅酸盐仪器有______。
(5)“操作I”后,向溶液中加入NaOH溶液来调节溶液的pH,以获得Ce(OH)3沉淀,常温下加入NaOH调节溶液的pH应大于_______即可认为Ce3 +已完全沉淀。
(已知:Ksp[Ce(OH)3]=1.0×10-20 )
(6)取上述流程中得到的Ce(OH)4产品5.000 g,加酸溶解后,向其中加入含0.03300 molFeSO4的FeSO4溶液使Ce4 +全部被还原成Ce3 +,再用0.1000 mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00 mL标准溶液。则该产品中Ce(OH)4的质量分数为________(已知氧化性:Ce4+>KMnO4; Ce(OH)4的相对分子质量为208)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为研究氯气的性质,设计如图所示装置进行实验,装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸.
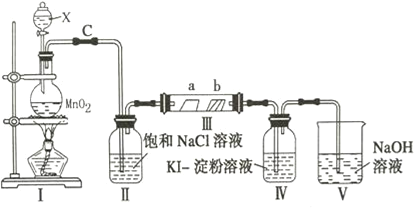
(1)写出仪器X的名称__________________.
(2)加入药品前,检查Ⅰ中气体发生装置气密性的操作是:用止水夹夹住C处_________________
(3)写出装置Ⅰ中发生反应的离子方程式_______________________________________
(4)实验过程中,装置Ⅳ中的实验现象为______________________________________
(5)实验过程中,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象的原因是______________________________________,为达到预期现象,应如何改进装置___.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下氨气和氧气能发生反应生成氮气和水蒸气:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H
查阅资料可得有关的化学键键能数据如下:
化学键 | N≡N | H-O | N-H | O=O |
E/ (kJ·mol-1) | 946 | 463 | 391 | 496 |
由此计算上述反应的反应热△H=___________kJ·mol-1。
(2)已知:N2(g)+O2(g)=2NO(g) K1
N2(g)+3H2(g)=2NH3(g) K2
2H2(g)+O2(g)=2H2O(g) K3
注:K1、K2、K3分别为上述三个反应的平衡常数
回答下列问题:
①氨催化氧化反应(生成气态水)的平衡常数K为___________(用K1、K2、K3表示)。
②一定条件下,将4molNH3和5.2molO2混合于容积为4L的恒容密闭容器中发生催化氧化反应,经过10s后达到平衡,测得NO的浓度为0.4mol/L则0到10s内,用NH3表示该反应的平均反应速率为___________,O2的转化率为___________(用百分数表示,且保留小数点后一位),该反应的平衡常数为___________(列出计算式即可)。
③若上述反应第一次达到平衡时,保持其他条件不变的情况下,只是将容器的体积扩大一倍,假定在25s后达到新的平衡。请在下图中用曲线表示15~30s这个阶段体系中NH3的浓度随时间变化的趋势。__________

(3)下列有关该反应的说法正确的是___________(填字母)。
A.恒温恒容,再充入4molNH3和5.2molO2,再次达到平衡时,NH3的转化率增大
B.恒温恒容,当容器内的密度保持不变时,反应达到了平衡
C.当混合气体的平均摩尔质量不变时,反应达到了平衡
D.当2v正(NO)=3v逆(H2O)时,反应达到了平衡
(4)工业上常用氨水吸收SO2,可生成(NH4)2SO3,请判断常温下(NH4)2SO3溶液的酸碱性并通过计算说明判断依据:_______________________________________________________。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成如图所示的原电池,下列叙述正确的是

A. KNO3盐桥中的K+移向CuSO4溶液
B. Ag作负极,Cu作正极
C. 工作一段时间后,CuSO4溶液中c(Cu2+)增大
D. 取出盐桥后,电流计的指针依然发生偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积不变的密闭容器中,反应I2(g) + H2(g)![]() 2HI(g)达到平衡的标志是( )
2HI(g)达到平衡的标志是( )
A.v正(I2)=2v逆(HI)
B.容器中气体的压强不再改变,气体的密度和摩尔质量不再改变
C.I2、H2、HI的分子数之比为1∶1∶2;
D.容器内气体的颜色不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A.5.6g Fe与2.24L Cl2充分反应转移电子数为0.2NA
B.0.1 mol KI与0.1 mol FeCl3在溶液中反应转移的电子数为0.1 NA
C.2 g H218O与D216O的混合物中所含中子、电子数目均为NA
D.16 g S8 (分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CH2=CH2+H2 → CH3CH3,反应过程的能量变化如图所示。下列说法正确的是

A. 此反应不属于氧化还原反应
B. 此反应的ΔH<0
C. 此反应中反应物的能量总和大于产物的能量总和
D. 1分子乙烯和1分子氢气的键能总和大于1分子乙烷的键能总和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下氨能被Cl2、Br2等氧化,已知以下反应:8NH3+3Cl2→6NH4Cl+N2。
(1)用单线桥标出电子转移的方向和数目______。
(2)这一反应中,氧化剂是______,氧化产物是______。
(3)若有3mol N2生成,则发生氧化反应的物质有______mol
(4)根据上述反应,若将浓氨水与Cl2靠近,将会看到______(现象)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com