
【题目】稀土是一种重要的战略资源。氟碳铈矿主要化学成分为CeFCO3,它是提取铈等稀土元素的重要矿物原料。氟碳铈矿的冶炼工艺流程如下:
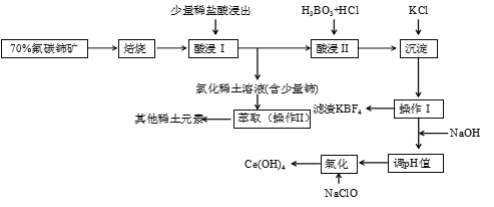
已知:i.铈的常见化合价为+3、+4。焙烧后铈元素转化成CeO2和CeF4。四价铈不易进入溶液,而三价稀土元素易进入溶液。
ii.酸浸II中发生反应:
9CeO2 + 3CeF4 + 45HCl + 3H3BO3 = Ce(BF4)3↓+ 11CeCl3 + 6Cl2↑+ 27H2O
请回答下列问题:
(1)①焙烧氟碳铈矿的目的是______________________________________。
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:___________________________________________。
CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:___________________________________________。
(2)在酸浸I中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。少量铈进入稀土溶液发生反应的离子方程式是_________________________________________________________
(3)向Ce(BF4)3中加入KCl溶液的目的是_____________________________________。
(4)操作I的名称为__________,在实验室中进行操作II时所需要的硅酸盐仪器有______。
(5)“操作I”后,向溶液中加入NaOH溶液来调节溶液的pH,以获得Ce(OH)3沉淀,常温下加入NaOH调节溶液的pH应大于_______即可认为Ce3 +已完全沉淀。
(已知:Ksp[Ce(OH)3]=1.0×10-20 )
(6)取上述流程中得到的Ce(OH)4产品5.000 g,加酸溶解后,向其中加入含0.03300 molFeSO4的FeSO4溶液使Ce4 +全部被还原成Ce3 +,再用0.1000 mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00 mL标准溶液。则该产品中Ce(OH)4的质量分数为________(已知氧化性:Ce4+>KMnO4; Ce(OH)4的相对分子质量为208)。
【答案】将铈氧化为四价便于与其他稀土元素分离 2xCO + CeO2 = CeO2(1-x) + 2xCO2 8H++2Cl-+2CeO2=2Ce3++Cl2↑+4H2O 避免Ce3+以Ce(BF4)3形式沉淀而损失(或将Ce3+全部转化为CeCl3,提高产率 过滤 分液漏斗、烧杯 9 95.68%
【解析】
氟碳铈矿主要化学成分为CeFCO3,用硫酸强化焙烧得浸出液中含有氟离子、铈离子、硫酸等,尾气中主要含有二氧化碳,加入碳酸钙会生成硫酸钙和氟化钙等难溶物为滤渣,和硫酸稀土溶液,在硫酸稀土溶液中加入萃取剂,经过分液将溶液中的Ce3+萃取出来,再加入稀硫酸得含有Ce3+的溶液,调节溶液的pH值得Ce(OH)3沉淀,再经过氧气氧化,过滤、洗涤、干燥可得Ce(OH)4产品,以此解答该题。
(1)①通过焙烧氟碳铈矿,可将铈氧化为四价,便于与其他稀土元素分离。②尾气消除过程中发生着CeO2CeO2(1-x)+xO2↑(0≤x≤0.25)的循环,可知CeO2具有氧化性,可氧化CO生成CO2,则CeO2消除CO尾气的化学方程式为2xCO+CeO2=CeO2(1-x)+2xCO2;(2)在酸浸I中用盐酸溶解CeO2,有少量铈进入滤液,可知有Ce3+生成,且产生黄绿色气体,此气体为Cl2,则此时发生反应的离子方程式是8H++2Cl-+2CeO2=2Ce3++Cl2↑+4H2O;(3)向Ce(BF4)3中加入KCl溶液生成CeCl3和KBF,这样做的目的是避免三价铈以Ce(BF4)3沉淀的形式损失或除去BF4-或提高CeCl3的产率;(4)操作I为固液分离,应选择过滤操作;操作II为萃取,则所需要的硅酸盐仪器有分液漏斗、烧杯;(5)溶液中的C(Ce3+)等于1×10-5molL-1,可认为Ce3+沉淀完全,根据KSP[Ce(OH)3]=C(Ce3+)C3(OH-)=1×10-20可知,C(OH-)=![]() molL-1=1×10-5molL-1,此时溶液的PH为9,即加入NaOH调节溶液的pH应大于9即可认为Ce3 +已完全沉淀;(6)用0.1000 mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00 mL标准溶液,主要是氧化溶液中剩余的Fe2+,根据电子守恒剩余Fe2+的物质的量为0.1000 mol·L-1×0.02L×
molL-1=1×10-5molL-1,此时溶液的PH为9,即加入NaOH调节溶液的pH应大于9即可认为Ce3 +已完全沉淀;(6)用0.1000 mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00 mL标准溶液,主要是氧化溶液中剩余的Fe2+,根据电子守恒剩余Fe2+的物质的量为0.1000 mol·L-1×0.02L×![]() =0.01mol,则还原Ce4 +消耗的Fe2+的物质的量为0.03300 mol-0.01mol=0.02300mol,根据Ce4 ++ Fe2+= Fe3++ Ce3 +,则Ce4 +的物质的量为0.02300mol,该产品中Ce(OH)4的质量分数为
=0.01mol,则还原Ce4 +消耗的Fe2+的物质的量为0.03300 mol-0.01mol=0.02300mol,根据Ce4 ++ Fe2+= Fe3++ Ce3 +,则Ce4 +的物质的量为0.02300mol,该产品中Ce(OH)4的质量分数为![]() =95.68%。
=95.68%。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】氨基乙酸(H2NCH2COOH)是蛋白质的水解产物之一,1 mol 的氨基乙酸中含有( )
A.2 mol氧气分子
B.12 mol氢原子
C.6.02×1023个H+
D.6.02×1023个氨基乙酸分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X是合成一种新型抗肝炎药的中间体,其生产路线如下:
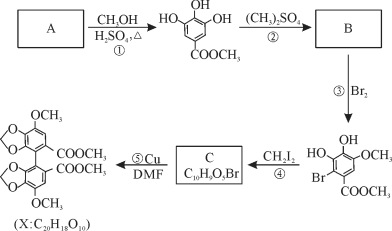
回答下列问题:
(1)反应①的反应类型为_____________。
(2)反应③的化学方程式为____________________________________________________。
(3)反应④生成C的结构简式为______________________,无机产物为_____(填化学式)。
(4)A有多种同分异构体,同时符合下列条件的有______种(不考虑立体异构)。请写出其中一种核磁共振氢谱有4组峰,且峰面积之比为2∶2∶1∶1的结构简式___________。
a.苯环上有4个取代基;
b.与FeCl3溶液发生显色反应;
c.能发生水解反应。
(5)参照上述合成路线及信息,以氯气、苯和一氯乙烯为原料(其它试剂任选),设计制备聚苯乙烯的合成路线____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将8.00gCuO和Fe2O3的混合物分成两等份,其中一份在高温下用足量CO还原后,剩余固体质量为2.88g;另一份固体用200mL某浓度的盐酸恰好溶解,则:
(1)混合物中CuO和Fe2O3的物质的量之比为:________________________
(2)所用盐酸的物质的量浓度为_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,回答下列问题:

(1)表中用于半导体材料的元素在周期表中的位置________________________。
(2)写出短周期金属性最强的元素的离子结构示意图:_____。
(3)③、④、⑤三元素离子半径从大到小的顺序是________________填离子符号)。
(4)②、③、④的气态氢化物,稳定性最强的是_______________填化学式)。
(5)设计实验证明⑤、⑥的金属性强弱__________________________。
(6)在一定条件下,利用置换反应可实现物质之间的转化(仅限于①-⑨中涉及的元素)
①同族元素之间,则反应可能为_____________。
②不同族元素之间,则反应可能为_____________(以上反应各写一条化学方程式即可)。
(7)将⑨的单质通入石蕊溶液中发生的颜色变化如下图,请在方框内填写出导致该阶段颜色变化的主要粒子符号。_____________、_____________、_____________。
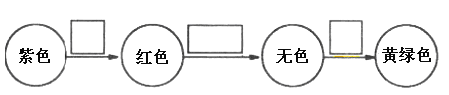
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个1L的密闭容器中加2molA和1molB发生反应: 2A(g)+B(g)![]() 3C(g)+D(s),达到平衡时C的浓度为1.2mol/L , C的体积分数为a% 。维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L,C的体积分数仍为a% 的是
3C(g)+D(s),达到平衡时C的浓度为1.2mol/L , C的体积分数为a% 。维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L,C的体积分数仍为a% 的是
A. 6mol C+2mol D B. 4mol A+2mol B
C. 1mol A+0.5mol B+1.5mol C D. 3mol C+5mol D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,Cl-的物质的量浓度最大的是( )
A.300 mL0.1 mol/L NaCl溶液B.10 mL0.2 mol/LAlCl3溶液
C.标况下4.48LHCl气体配成的1 L溶液D.100 mL0.1 mol/LFeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO(g)和H2O(g)以1 : 2体积比分别通入到体积为2 L的恒容密闭容器中进行反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:

下列说法不正确的是
A. 从实验数据分析,该反应的正反应是吸热反应
B. 实验A中,在0~10min内,以v(H2)表示的反应速率大于0.013mol(L·min)-1
C. 从生产效益分析,C组实验的条件最佳
D. 比较实验B、C,说明C实验使用了更高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,下列说法正确的是
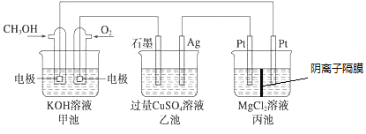
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使溶液恢复原浓度
D. 甲池中消耗4.48L(标准状况下)O2,此时丙池中理论上最多产生23.2 g固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com