
【题目】下列溶液中,Cl-的物质的量浓度最大的是( )
A.300 mL0.1 mol/L NaCl溶液B.10 mL0.2 mol/LAlCl3溶液
C.标况下4.48LHCl气体配成的1 L溶液D.100 mL0.1 mol/LFeCl3溶液
科目:高中化学 来源: 题型:
【题目】某学生探究0.25 mol·L-1 Al2(SO4)3溶液与0.5 mol·L-1 Na2CO3溶液的反应,实验如下。下列分析错误的是
实验1 |
|
实验2 |
|
A. 实验1中,白色沉淀a是Al(OH)3
B. 实验2中,白色沉淀b中含有CO![]()
C. 检验白色沉淀a、b是否洗涤干净,不可使用相同的检验试剂
D. 实验1、2中,白色沉淀成分不同可能与混合后溶液的pH有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土是一种重要的战略资源。氟碳铈矿主要化学成分为CeFCO3,它是提取铈等稀土元素的重要矿物原料。氟碳铈矿的冶炼工艺流程如下:
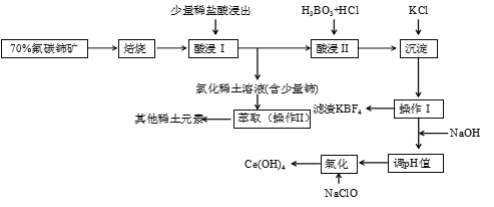
已知:i.铈的常见化合价为+3、+4。焙烧后铈元素转化成CeO2和CeF4。四价铈不易进入溶液,而三价稀土元素易进入溶液。
ii.酸浸II中发生反应:
9CeO2 + 3CeF4 + 45HCl + 3H3BO3 = Ce(BF4)3↓+ 11CeCl3 + 6Cl2↑+ 27H2O
请回答下列问题:
(1)①焙烧氟碳铈矿的目的是______________________________________。
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:___________________________________________。
CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:___________________________________________。
(2)在酸浸I中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。少量铈进入稀土溶液发生反应的离子方程式是_________________________________________________________
(3)向Ce(BF4)3中加入KCl溶液的目的是_____________________________________。
(4)操作I的名称为__________,在实验室中进行操作II时所需要的硅酸盐仪器有______。
(5)“操作I”后,向溶液中加入NaOH溶液来调节溶液的pH,以获得Ce(OH)3沉淀,常温下加入NaOH调节溶液的pH应大于_______即可认为Ce3 +已完全沉淀。
(已知:Ksp[Ce(OH)3]=1.0×10-20 )
(6)取上述流程中得到的Ce(OH)4产品5.000 g,加酸溶解后,向其中加入含0.03300 molFeSO4的FeSO4溶液使Ce4 +全部被还原成Ce3 +,再用0.1000 mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00 mL标准溶液。则该产品中Ce(OH)4的质量分数为________(已知氧化性:Ce4+>KMnO4; Ce(OH)4的相对分子质量为208)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N键断裂的同时,有3个H﹣H键断裂
②一个N≡N键断裂的同时,有6个N﹣H键断裂
③其他条件不变时,混合气体平均相对分子质量不再改变
④恒温恒容时,体系压强不再改变
⑤NH3、N2、H2的体积分数都不再改变
⑥恒温恒容时,混合气体密度保持不变
⑦正反应速率v(H2)=0.6molL﹣1min﹣1,逆反应速率v(NH3)=0.4molL﹣1min﹣1
A. 全部 B. ②③④⑤ C. ②③④⑤⑦ D. ③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用溶解、过滤、结晶的方法来分离的一组物质是 ( )
A. NaCl 和 淀粉 B. BaSO4 和 CaCO3
C. CuO 和 KCl D. Mg(NO3)2 和 I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同位素在化学研究方面有重要用途,化学家利用18O成功研究了某化学反应的历程。下列关于18O与16O的叙述错误的是
A.18O 与16O 的物理性质相同
B.18O 与 16O的化学性质相同
C.18O 与 16O的质子数相同
D.18O与 16O的中子数不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为研究氯气的性质,设计如图所示装置进行实验,装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸.
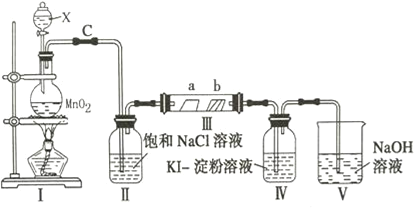
(1)写出仪器X的名称__________________.
(2)加入药品前,检查Ⅰ中气体发生装置气密性的操作是:用止水夹夹住C处_________________
(3)写出装置Ⅰ中发生反应的离子方程式_______________________________________
(4)实验过程中,装置Ⅳ中的实验现象为______________________________________
(5)实验过程中,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象的原因是______________________________________,为达到预期现象,应如何改进装置___.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A.5.6g Fe与2.24L Cl2充分反应转移电子数为0.2NA
B.0.1 mol KI与0.1 mol FeCl3在溶液中反应转移的电子数为0.1 NA
C.2 g H218O与D216O的混合物中所含中子、电子数目均为NA
D.16 g S8 (分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com