
【题目】某校化学兴趣小组为研究氯气的性质,设计如图所示装置进行实验,装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸.
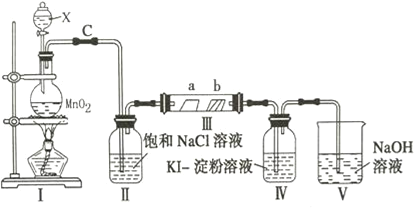
(1)写出仪器X的名称__________________.
(2)加入药品前,检查Ⅰ中气体发生装置气密性的操作是:用止水夹夹住C处_________________
(3)写出装置Ⅰ中发生反应的离子方程式_______________________________________
(4)实验过程中,装置Ⅳ中的实验现象为______________________________________
(5)实验过程中,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象的原因是______________________________________,为达到预期现象,应如何改进装置___.
【答案】分液漏斗 橡皮管,然后向分液漏斗中加水,打开分液漏斗活塞,液体不能顺利流下则气密性好 MnO2+4H++2Cl﹣![]() Mn2++Cl2↑+2H2O 无色溶液变蓝色 氯气中的水蒸气 在Ⅱ和Ⅲ之间可加浓硫酸干燥装置,来干燥Cl2
Mn2++Cl2↑+2H2O 无色溶液变蓝色 氯气中的水蒸气 在Ⅱ和Ⅲ之间可加浓硫酸干燥装置,来干燥Cl2
【解析】
制备实验或实验性质的验证,一般遵循的步骤是制气装置→除杂装置→收集装置或验证性质的装置→尾气处理装置,据此分析;
(1)根据装置图,仪器X为分液漏斗;
(2)检验装置I的气密性,操作方法是用止水夹夹住C处橡皮管,然后向分液漏斗中加水,打开分液漏斗活塞,液体不能顺利滴下则气密性良好;或向装置II加入蒸馏水没过长导管,关闭分液漏斗的活塞,微热圆底烧瓶,装置II导管口有气泡冒出,停止加热,长导管口有液柱,说明气密性良好;
(3)装置I制取氯气,其离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(4)Cl2的氧化性强于I2,能将I-氧化成I2,淀粉遇碘单质变蓝,即装置IV中的现象是无色溶液变蓝色;
(5)干燥的氯气不具有漂白性,气体通过装置II,只是除去氯气中氯化氢,即装置II中出来的氯气中含有水蒸气,能使a处品红试纸褪色,因此需要在装置II和III之间可加干燥装置除去氯气中的水蒸气。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】X是合成一种新型抗肝炎药的中间体,其生产路线如下:
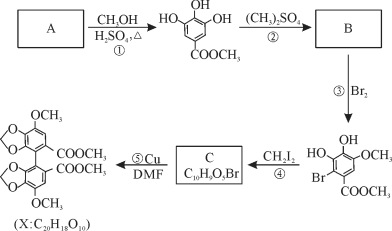
回答下列问题:
(1)反应①的反应类型为_____________。
(2)反应③的化学方程式为____________________________________________________。
(3)反应④生成C的结构简式为______________________,无机产物为_____(填化学式)。
(4)A有多种同分异构体,同时符合下列条件的有______种(不考虑立体异构)。请写出其中一种核磁共振氢谱有4组峰,且峰面积之比为2∶2∶1∶1的结构简式___________。
a.苯环上有4个取代基;
b.与FeCl3溶液发生显色反应;
c.能发生水解反应。
(5)参照上述合成路线及信息,以氯气、苯和一氯乙烯为原料(其它试剂任选),设计制备聚苯乙烯的合成路线____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,Cl-的物质的量浓度最大的是( )
A.300 mL0.1 mol/L NaCl溶液B.10 mL0.2 mol/LAlCl3溶液
C.标况下4.48LHCl气体配成的1 L溶液D.100 mL0.1 mol/LFeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO(g)和H2O(g)以1 : 2体积比分别通入到体积为2 L的恒容密闭容器中进行反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:

下列说法不正确的是
A. 从实验数据分析,该反应的正反应是吸热反应
B. 实验A中,在0~10min内,以v(H2)表示的反应速率大于0.013mol(L·min)-1
C. 从生产效益分析,C组实验的条件最佳
D. 比较实验B、C,说明C实验使用了更高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJmol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJmol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJmol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJmol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)== ![]() CH3OCH3(g)+
CH3OCH3(g)+ ![]() H2O(1)的ΔH =
H2O(1)的ΔH =![]() kJmol-1
kJmol-1
D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸剧烈反应,能够引起燃烧。某化学科研小组准备使用下列装置制备LiH固体。下列说法正确的是
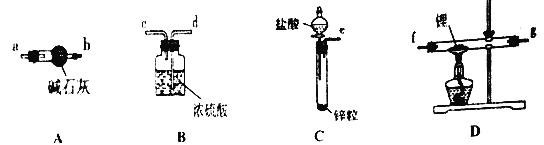
A. 上述仪器装置按气流从左到右连接顺序为:e接d,c接f,g接a,b(和g调换也可以)
B. 实验中所用的金属锂保存在煤油中
C. 在加热D处的石英管之前,应先通入一段时间氢气,排尽装置内的空气
D. 干燥管中的碱石灰可以用无水CaCl2代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在进行化学实验时,经常会有与预期不符的现象出现。某化学实验小组在实验室进行铁盐与亚铁盐相互转化的实验,就出现了与预设不太一致的现象。
实验I:将Fe3+转化为Fe2+
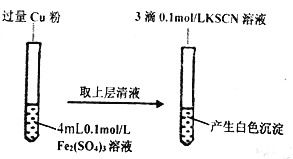
(1)Fe3+与Cu粉发生反应的离子方程式为_________________________________。
(2)该小组同学用对比实验法探究白色沉淀产生的原因,请将其方案补充完整:
实验方案 | 现象 | 结论 |
步骤1:取4mL_________mol/ L CuSO4溶液,向其中滴加3滴0.1mo/ L KSCN溶液 | 产生白色沉淀 | Cu SO4与KSCN反应产生了白色沉淀 |
步骤2:取4mL0.2mol/ L FeSO4溶液,向其中滴加3滴0.1mol/ L KSCN溶液 | ___________ |
查阅资料:①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
③(SCN)2的化学性质与I2相似
则Cu2+与SCN-反应的离子方程式为____________________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/L FeSO4溶液中加入lmL8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色) ②Fe(NO)2+与HNO3不反应
Fe(NO)2+(棕色) ②Fe(NO)2+与HNO3不反应
(3)用离子方程式解释NO产生的原因____________________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应I:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应I的速率比反应Ⅱ___________(填“快”或“慢”)。
②乙认为反应I是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是_______________________________________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因______________________。
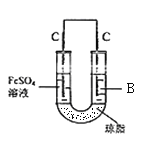
(5)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,他利用实验室常用的仪器和药品设计并完成了如图所示的实验,实现了Fe2+![]() Fe3+的转化,同时避免出现此异常现象。实验发现:U形管右侧有气泡,U形管左侧的现象为___________、B溶液是___________溶液(填化学式)。
Fe3+的转化,同时避免出现此异常现象。实验发现:U形管右侧有气泡,U形管左侧的现象为___________、B溶液是___________溶液(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,下列说法正确的是
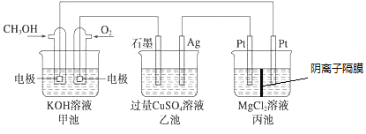
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使溶液恢复原浓度
D. 甲池中消耗4.48L(标准状况下)O2,此时丙池中理论上最多产生23.2 g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有6.02×1023个H3PO4 中氧原子的物质的量是( )
A. 1.00 mol B. 0.50 mol C. 4mol D. 0.125 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com