
【题目】CO(g)和H2O(g)以1 : 2体积比分别通入到体积为2 L的恒容密闭容器中进行反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:

下列说法不正确的是
A. 从实验数据分析,该反应的正反应是吸热反应
B. 实验A中,在0~10min内,以v(H2)表示的反应速率大于0.013mol(L·min)-1
C. 从生产效益分析,C组实验的条件最佳
D. 比较实验B、C,说明C实验使用了更高效的催化剂
【答案】A
【解析】
A、根据实验组B和C,升高温度,CO2的物质的量减少,说明升高温度,平衡向逆反应方向移动,即正反应是为放热反应,故A错误;B、达到平衡时,v(CO2)=![]() mol/(L·min)=0.13mol/(L·min),化学反应速率之比等于化学计量数之比,即v(H2)=c(CO2)=0.13mol/(L·min),随着反应的进行,反应物的浓度减小,化学反应速率降低,0~10min内,v(H2)>0.130.13mol/(L·min),故B正确;C、根据表格数据,实验C温度低,投入量少,达到平衡时间短,因此从生产效益分析,C组实验的条件最佳,故C正确;D、B的温度高于C的温度,但达到平衡时间相等,说明C使用了比较高效的催化剂,故D正确。
mol/(L·min)=0.13mol/(L·min),化学反应速率之比等于化学计量数之比,即v(H2)=c(CO2)=0.13mol/(L·min),随着反应的进行,反应物的浓度减小,化学反应速率降低,0~10min内,v(H2)>0.130.13mol/(L·min),故B正确;C、根据表格数据,实验C温度低,投入量少,达到平衡时间短,因此从生产效益分析,C组实验的条件最佳,故C正确;D、B的温度高于C的温度,但达到平衡时间相等,说明C使用了比较高效的催化剂,故D正确。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各数值表示元素原子序数,在各组中能以离子键相互结合成稳定化合物的是( )
A. 10和19 B. 6和16 C. 11和17 D. 14和8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组溶液混合时,相互滴加的次序不同,现象也不同的是( )
A.氢氧化钠溶液与氯化铝溶液B.氢氧化钠溶液与盐酸
C.碳酸氢钠溶液与盐酸D.氢氧化钠溶液与氯化铁溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种物质的能量关系如下图所示。下列说法正确的是
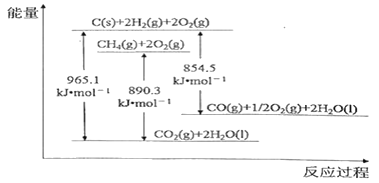
A. C(s)+O2(g)=CO2(g) △H =—965.1 kJ·mol-1
B. 2CO(g)+O2(g)=2CO2(g) △H =-221.2 kJ·mol-1
C. 由图可知,甲烷的燃烧热为779.7 kJ·mol-1
D. 通常由元素最稳定的单质生成生成1mol纯化合物时的反应热称为该化合物的标准生成焓,由图可知,CH4(g)的标准生成焓为+74.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用MgBr2稀溶液模拟从海水中制取无水氯化镁和溴单质,实验流程如下,下列说法不正确的是
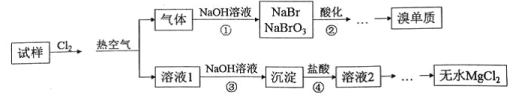
A. 步骤①中的NaOH溶液,可用Na2CO3、Na2SO3溶液代替
B. 步骤②可用硫酸酸化,发生的离子反应为5Br—+BrO3—+6H+=3Br2+3H2O
C. 步骤③包含过滤、洗涤等操作,可用AgNO3溶液检验是否洗涤干净
D. 经步骤③④,溶液1和溶液2的主要成份是相同的,但浓度上有较大差异
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
![]()
其中第①步存在平衡:2CrO42—(黄色)+2H+![]() Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72—和CrO42—的浓度相同 b.2v (Cr2O72—) ="v" (CrO42—) c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
( 4 ) 第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)![]() Cr3+(aq)+3OH—(aq)
Cr3+(aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为 。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释) 。
溶液中同时生成的沉淀还有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
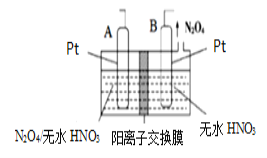
【题目】氮的氧化物种类较多,有N2O、NO、N2O3、NO2、N2O4、N2O5等,它们应用广泛。
(1)N2O是人类最早应用于医疗的麻醉剂之一。它可由NH4NO3在加热条件下分解产生,此反应的化学方程式为______________________________。
(2)N2O4可作火箭高能燃料N2H4的氧化剂。已知:2NO2(g)![]() N2O4(g)△H=﹣akJmol﹣1;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣bkJmol﹣1;N2(g)+2O2(g)=2NO2(g)△H=+ckJmol﹣1;(a、b、c均大于0)。写出气态肼(N2H4)在气态(N2O4)中燃烧生成氮气和气态水的热化学方程式________。
N2O4(g)△H=﹣akJmol﹣1;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣bkJmol﹣1;N2(g)+2O2(g)=2NO2(g)△H=+ckJmol﹣1;(a、b、c均大于0)。写出气态肼(N2H4)在气态(N2O4)中燃烧生成氮气和气态水的热化学方程式________。
(3)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压 × 物质的量分数[例如p(NO2)=p总×x(NO2)]。则反应2NO2(g)N2O4(g)△H=﹣akJmol﹣1平衡常数Kp表达式为______(用p总、和各气体物质的量分数x表示)。
(4)新型绿色硝化剂N2O5可以通过N2O4为原料用电解法制备,实验装置如图所示。则电极B接直流电源的___极,电解池中生成N2O5的电极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列事实得出的结论正确的是
A. 试样![]() 产生银镜 结论:该试样是醛类
产生银镜 结论:该试样是醛类
B. 某卤代烃试样![]() 最终的沉淀不是白色;结论:该卤代烃中不含氯原子
最终的沉淀不是白色;结论:该卤代烃中不含氯原子
C. 往淀粉溶液中加入稀硫酸并且加热一段时间,再加入新制的氢氧化铜悬蚀液再加热。发现没有红色沉淀生成;结论: 淀粉没有水解生成葡萄糖
D. 将溴乙烷和NaOH的醇溶液混合加热,得到的气体先通入水中再通入酸性KMnO4溶液,溶溶褪色,说明发生消去反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com