
����Ŀ������ʽ��������������Na2SO4��ˮ��ԭ����ͼ��ʾ�����ö��Ե缫��ab��cd��Ϊ���ӽ���Ĥ����ֱ���糡�������£���Ĥ�м��Na+��SO42-��ͨ�����ӽ���Ĥ�������˸��������ӱ��赲���ܽ����м���ҡ�����������ȷ����

A. ͨ����м���ҵ�SO42-����������Ǩ�ƣ���������ҺpH����
B. �÷��ڴ�����Na2SO4��ˮʱ���Եõ�NaOH��H2SO4��Ʒ
C. ������ӦΪ2H2O�C4e�C=O2+4H+����������ҺpH����
D. ����·��ͨ��1mol���ӵĵ���ʱ������0.5mol��O2����
���𰸡�B
�������� A������ͬ�ֵ����ų⣬���ֵ���������ԭ���ڵ����������ӻ�������ɽ϶�������������ƶ������ͨ����м���ҵ�SO42������������Ǩ�ƣ���������������ɵ�OH��ʧȥ���ӣ�����������Ӧ���ŵ磬�����ƻ��˸�����ˮ�ĵ���ƽ�⣬ʹ��Һ��c(H��)>c(OH��)��������������Һ������ǿ����Һ��pH��С����A����B���������������ŵ磬��Һ�в������ᣬ�����������ӻ�õ��ӣ�������ԭ��Ӧ���ŵ磬�ƻ��˸�����ˮ�ĵ���ƽ�⣬ʹ��Һ��c(OH��)>c(H��)�����Բ����������ƣ���˸÷��ڴ�����Na2SO4��ˮʱ���Եõ�NaOH��H2SO4��Ʒ����B��ȷ��C�������������ӵõ����ӣ�ʹ��Һ��c(H��)�������Ը�������ҺpH���ߣ���C����D������·��ͨ��1mol���ӵĵ���ʱ�����������պϻ�·�е���ת����Ŀ��ȿ�֪��Ӧ�������������ʵ�����n(O2)=1mol��4=0.25mol����D����ѡB��


 ��ٽ������½������������ϵ�д�
��ٽ������½������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���û���Ӧ�ɱ�ʾΪ��
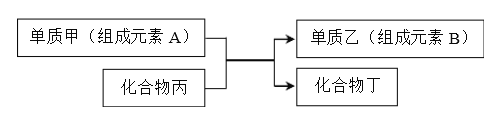
�ش�����������
��1�������������ɻ��Ϸ�Ӧ�Ƶã��������ɵ������ᷢ���û���Ӧ�õ�����__________��
A.AgCl B.FeCl2 C.AlCl3 D.FeCl3
��2����A��B���Ƕ�����Ԫ�أ���B��ԭ��������A��������A��Ԫ�����ڱ��е�λ��
��_____________��
��3��������һ�ֳ����뵼����ϣ���ҵ������������Ӧ��ȡ�ҵĻ�ѧ����ʽΪ____________��
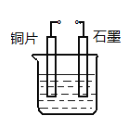
��4��������Cu������H2��ijѧ�������ͼ�绯ѧװ��ʵ�ָ��û���Ӧ����ͭƬΪ________��(������������ �������� �������� ����)��ʯī�ϵĵ缫��Ӧ______________��
��5����������������Fe3O4�������ļ������ȫ��Ӧ�����ӷ�Ӧ�����з���������ҵĻ�ѧ������_______________��
��6��Cl2��NH3�ɷ����û���Ӧ������������ȥ��ͼ��ʾװ���еIJ���Ƭ��ʹCl2��NH3��ַ�Ӧ��
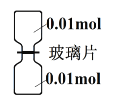
��NH3��___________ƿ(����������������) ��
����Ӧ�У���������B Ԫ����δ��������B Ԫ��֮����_________��
����Ӧ��ȡ����ƿ�ڸ��ŵĹ�����������ˮ�У�������Һ�и�����Ũ���ɴ�С��˳����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��Т�Na2CO3��Һ ��CH3COONa��Һ ��NaOH��Һ ��CH3COONH4��Һ��25mL�����ʵ���Ũ�Ⱦ�Ϊ0.l mol/L������˵����ȷ������ ��
A. ������Һ��pH��С˳���Ǣ�>��>��>��
B. ���ֱ����25 mL 0.1 mol/L�������ַ�Ӧ��pH�����Ǣ�
C. ����������Һϡ����ͬ������pH�仯�����Ǣ�
D. �����¶ȣ�����Һ��pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��A��B������Ҫ���л��ϳ�ԭ�ϵĽṹ�������й�˵������ȷ����
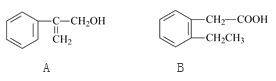
A. A��B��Ϊͬϵ��
B. A��B������������Ȼ�̼��Һ�����ӳɷ�Ӧ
C. ��һ�������£�A��B���ܷ���ȡ����Ӧ
D. A��B������NaHCO3��Һ��Ӧ����CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��Ϊ��֤SO2�Ļ�ԭ�ԣ��������������̽�����
I.����Ԥ��
����ȤС��ʵ��ʵʩǰ�����˳�ֵ����۽�����ȷ��ѡ��SO2��FeCl3��Һ�ķ�Ӧ��̽������Ԥ�⽫SO2ͨ��FeCl3��Һ�е�����С��ͬѧ��������ķ���������Ϊ���ܹ۲쵽��������:_____________����Ԥ�������������(�����ӷ���ʽ��ʾ):________________________��
II.ʵ��̽��
(1)����1mol/LFeCl3��Һ(δ�������ữ)
��������С����λͬѧ��������Һʱ�ġ�ת�ơ�������������ȷ����:_______________��
�ڲ���Һ��pH��֪��Һ�����ԣ���ԭ����:____________________ (�����ӷ���ʽ��ʾ)��
(2)SO2ͨ��FeCl3��Һ�����ͣ��۲쵽��Һ���ػ�ɫ��Ϊ����ɫ����û�й۲쵽Ԥ�ڵ�������Ӧ�����Һ����12Сʱ���ֳ�����Ԥ�ڵĽ����
�������ϵ�֪[Fe(HSO3)]2+Ϊ����ɫ������[Fe(HSO3)]2+�ķ�ӦΪ���淴Ӧ�������û�ѧ����ʽ���ͽ�SO2ͨ��FeCl3��Һ������ʱ�۲쵽������:_______________��
(3)Ϊ��̽��������̺���ɫ��ΪԤ����ɫ��ʱ�䣬С�����̽��:��ȡ����FeCl3��Һ����ͨ��SO2��Һ��Ϊ����ɫ,��ŨHCl�ữ�������Ӻ��ΪԤ����ɫ��
�����Ʋ�С����ʵ�鷽������С���ŨHC1�ữ����Ŀ����:_______________��
III.���������
ͨ��̽����С��ͬѧ�����������������ࡣ���磬��ͬѧ��Ϊ��ʵ����ǻ�ѧ����߷�ͥ������д��һ����ĸ�����ͬѧ����:______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������֪��Br2�ķе�Ϊ58.78�棬�ܶ�Ϊ3.119gcm��3������ˮ���ж���
��1�������£�������ͨ����__̬������ʱͨ����ʢ����Լ�ƿ�м�������__Һ�⡣
��ҵ�����У���ˮ��ȡ�峣�ÿ��������������������̿�����ͼ��ʾ��
Ũ����ˮ![]() ��Ũ����ˮ
��Ũ����ˮ![]() ��Br������Һ
��Br������Һ![]() ���Ũ��Һ��Һ��
���Ũ��Һ��Һ��
ij��ѧʵ��С��ģ��÷��������ͼʵ��װ�ã��г�װ����ȥ����Ũ���ĺ�ˮ����ȡҺ��ʵ�鲽�����£�
�ٹرջ���b��d������a��c����A�л���ͨ��Cl2������Ӧ������
�ڹر�a��c����b��d����A�й��������ȿ�����
�۹ر�b����a����ͨ��A��B��ͨ��������Cl2��
�ܽ�B������Һ����������ռ�Һ�塣
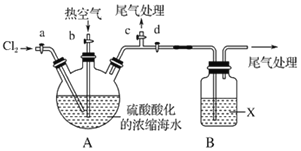
��2�����۲쵽A��Һ���Ϸ�����____��ʵ���������жϲ�����з�Ӧ�Ѿ�������
��3��X�Լ�������___��β������ѡ��___������ţ��Լ����ظ�ʹ�ã���
a��H2O b������ʳ��ˮ c��NaOH��Һ d������Na2SO3��Һ
B��X�Լ�������Ӧ�����ӷ���ʽΪ____________________________________��
��4������ʱӦ��ѡ����������_____������ţ���ʵ�������Ӧ�����¶�Ϊ_________ʱ�ռ�Һ�塣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Sb)���仯�����ڹ�ҵ����������;���Ի����(��Ҫ�ɷ�ΪSb2S3��������PbS��As2S3��CuO��SiO2��)Ϊԭ���Ʊ�������Ĺ���������ͼ��ʾ��
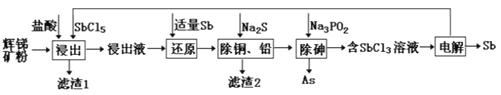
��֪���ٽ���Һ�г������������SbCl5֮�⣬������SbCl3��PbCl2��AsCl3��CuCl2�ȣ�
�ڳ����£�Ksp(CuS)=1.27��10-36��Ksp(PbS)=9.04��10-29��
����Һ������Ũ��С�ڵ���1.0��10-5mol��L-1ʱ����Ϊ�����ӳ�����ȫ��
��1������1�г���S֮�⣬����___________���ѧʽ����
��2����������ʱ��Sb2S3������Ӧ�Ļ�ѧ����ʽΪ_______________��
��3������ԭ��ʱ����Sb��ԭ������Ϊ___________���ѧʽ����
��4�������£�����ͭ��Ǧ��ʱ��Cu2+��Pb2+��������ȫ����ʱ��Һ�е�c(S2-)������_________������Na2SҲ���˹��࣬��ԭ��Ϊ_____________________________��
��5������⡱ʱ����������SbԪ���뱻��ԭ��SbԪ�ص�����֮��Ϊ_________��
��6��һ��ͻ�ƴ�ͳ�����������þ-��Һ̬�������ܵ�ع���ԭ����ͼ��ʾ��
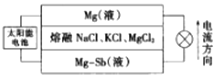
�õ�������ܶȵIJ�ͬ�������������·�Ϊ���㣬����ʱ�м�������ε���ɲ��䡣���ʱ��Cl-��_____����ϡ����¡����ƶ����ŵ�ʱ�������ĵ缫��ӦʽΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.���������ԭ��ѧ˵
B.��°����ˡ������Ƽ�����Ľ���̼���Ƶ���ȡ����
C.�����״��Ƶý�����
D.�Ž��з����Ԫ�����ڱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɱ�ϩ�����з�Ӧ�ɵõ�F��G���ָ߷��ӻ�������Ƕ��dz��ò���
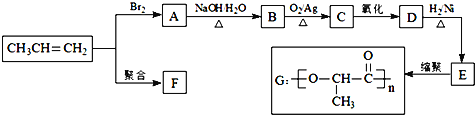
��1��E�й����ŵ�����_________��
��2��д��D�Ľṹ��ʽ_________��
��3���ۺ���F�Ľṹ��ʽ��____________________��
��4��Bת��ΪC�Ļ�ѧ����ʽ��______________________________��
��5����һ�������£�������E����ȥ������ˮ�γ�һ����Ԫ��������û�����Ľṹ��ʽ��_________��
��6��E�ж���ͬ���칹�壬д����E������ͬ�����ŵ�ͬ���칹��Ľṹ��ʽ_________����˴Ź���������ʾΪ__________��壬�����֮��Ϊ______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com