
【题目】几种物质的能量关系如下图所示。下列说法正确的是
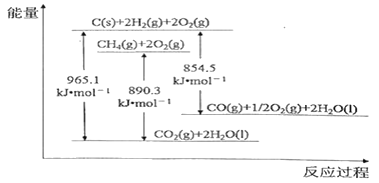
A. C(s)+O2(g)=CO2(g) △H =—965.1 kJ·mol-1
B. 2CO(g)+O2(g)=2CO2(g) △H =-221.2 kJ·mol-1
C. 由图可知,甲烷的燃烧热为779.7 kJ·mol-1
D. 通常由元素最稳定的单质生成生成1mol纯化合物时的反应热称为该化合物的标准生成焓,由图可知,CH4(g)的标准生成焓为+74.8 kJ·mol-1
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,答下列问題:
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2该反应氧化剂与还原剂物质的量之比为_______________。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
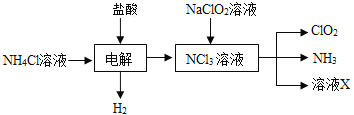
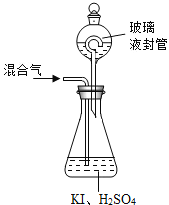
图1 图2
①电解时发生反应的化学方程式为_______________________________________________ 。
②溶液X中大量存在的阴离子有________________________________________________ 。
③除去ClO2中的NH3可选用的试剂是 ___________________(填标号)。
a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水
(3)用上图2装置可以测定混合气中ClO2的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入 3 mL 稀硫酸:
Ⅱ.在玻璃液封装置中加入水.使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为_______________________________。
②玻璃液封装置的作用是________________________________________________。
③V中加入的指示剂通常为___________,滴定至终点的现象是_________________________。
④测得混合气中ClO2的质量为____________________________ g.。
(4)O2处理过的饮用水会含有一定最的亚氯酸盐。若要除去超标的亚氯酸盐,下列物庾最适宜的是________(填标号)。
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取10.1g某卤代烃与足量NaOH溶液混合,充分反应后,加入足量AgNO3-HNO3混合溶液,生成18.8g浅黄色沉淀。则该卤代烃可能是
A. CH3Br B. CH3CH2Br C. CH2BrCH2Br D. CH3CHBrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子晶体是常见的晶体类型。请回答以下问题:
(1)离子晶体中阴阳离子半径之比是决定晶体构型的重要因素之一,配位数与离子半径之比存在如下关系:
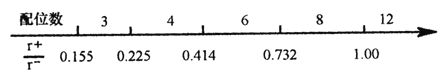
已知在某AB型离子化合物中,A+离子的半径为84pm,B-离子的半径为140pm。分析以上信息,与A+离子配位的所有B-离子,在空间构成的立体形状为_______。
(2)硫化亚铜和氧化亚铜均为离子晶体,其中熔点较高的为________ (填化学式),原因是________。
(3)向疏酸铜溶液中加入乙二胺(H2N-CH2-CH2-NH2)溶液后,每个Cu2+可与两个乙二胺分子形成四配位离子,导致溶液由蓝色变为紫色。该四配位离子的结构式为_______。
(4)K3C60是由足球烯(C60)与金属钾反应生成的盐。在K3C60晶胞中,C603-堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙,K+填充在空隙中。晶胞中被K+占据的空隙百分比为__________。
(5)H和Mg能形成一种离子型储氢材料,晶体结构如右图所示:
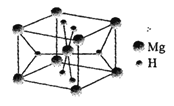
则该晶体中Mg的配位数是______,其化学式为________。已知该晶体的密度为ρg·cm-3,晶胞的体积为__________(用ρ、NA表示,其中NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1L0.lmol·L-1的氢氧化钾溶液中O—H键的数目为0.1NA
B. 0.5mol·L-1的碳酸钠溶液中CO32-的数目小于0.5NA
C. 4.6g金属钠与500mL0.2 mol·L-1稀盐酸充分反应,转移电子数为0.1 NA
D. 标准状况下,2.24L乙烯和甲烷混合气体中含有的氢原子数目为0.4 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CeO2通常既不溶于强酸,也不溶于强碱。某工厂以平板电视显示屏厂的废玻璃粉末(含CeO2、SiO2、Fe2O3、FeO等物质)为原料,设计如下图所示工艺流程,制得纯净的CeO2。下列说法正确的是( )
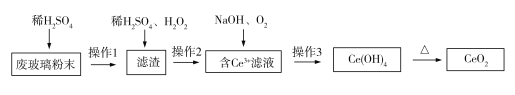
A. 实验室中,操作3和操作1、操作2所用仪器不同
B. 滤渣中加入稀H2SO4和H2O2,其中H2O2做氧化剂
C. 滤液中Ce3+与NaOH、O2的反应属于化合反应
D. 操作2分离得到的滤渣中一定含有未反应的SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO(g)和H2O(g)以1 : 2体积比分别通入到体积为2 L的恒容密闭容器中进行反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:

下列说法不正确的是
A. 从实验数据分析,该反应的正反应是吸热反应
B. 实验A中,在0~10min内,以v(H2)表示的反应速率大于0.013mol(L·min)-1
C. 从生产效益分析,C组实验的条件最佳
D. 比较实验B、C,说明C实验使用了更高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。为测定某样品中AlN的含量,设计如下二种实验方案。(已知:样品中的杂质不与NaOH反应,且AlN+NaOH+3H2O═Na[Al(OH)4]+NH3↑)
(方案1)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
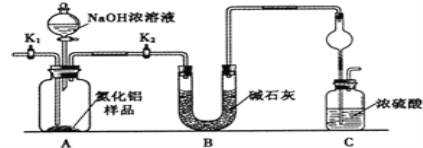
(1)如图C装置中球形干燥管的作用是______。
(2)完成以下实验步骤:组装好实验装置,首先______,再加入实验药品。接下来的实验操作是______,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是______。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见______。
(方案2)按以下步骤测定样品中AlN的纯度:
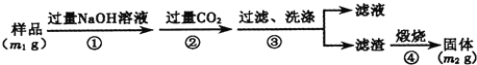
(4)步骤②生成沉淀的离子方程式为______。
(5)若在步骤③中未洗涤,测定结果将______(填“偏高”、“偏低”或“无影响”)。
(6)AlN的纯度为_____________(含m1,m2的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见右图)。下列说法错误的是

A. a、b两处的混合气体成分含量相同,温度不同
B. c、d两处的混合气体成分含量相同,温度不同
C. 热交换器的作用是预热待反应的气体,冷却反应后的气体
D. c处气体经热交换后再次催化氧化的目的是提高SO2的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com