
【题目】取10.1g某卤代烃与足量NaOH溶液混合,充分反应后,加入足量AgNO3-HNO3混合溶液,生成18.8g浅黄色沉淀。则该卤代烃可能是
A. CH3Br B. CH3CH2Br C. CH2BrCH2Br D. CH3CHBrCH2Br
【答案】D
【解析】由于是浅黄色沉淀,则该卤代烃为溴代烃,18.8g浅黄色沉淀为溴化银,其物质的量为:n(AgBr)=![]() =0.1mol,若该卤代烃为一卤代烃则其摩尔质量为:M=
=0.1mol,若该卤代烃为一卤代烃则其摩尔质量为:M=![]() =101g/mol,则烃基的相对分子量为:101-80=21;若该卤代烃为二卤代烃则其摩尔质量为:M=
=101g/mol,则烃基的相对分子量为:101-80=21;若该卤代烃为二卤代烃则其摩尔质量为:M=![]() =202g/mol,则烃基的相对分子量为:202-80×2=42;A.CH3Br中烃基为甲基:-CH3,其相对分子量为15,不满足条件,选项A错误;B.CH3CH2Br中烃基为乙基:-C2H5,其相对分子量为29,不满足条件,选项B错误;C.CH2BrCH2Br中烃基为-CH2CH2-,其相对分子量为28,不满足条件,选项C错误;D.CH3CHBrCH2Br中烃基为-CH(CH3)CH2-,其相对分子量为42,满足条件,,选项D正确;答案选D。
=202g/mol,则烃基的相对分子量为:202-80×2=42;A.CH3Br中烃基为甲基:-CH3,其相对分子量为15,不满足条件,选项A错误;B.CH3CH2Br中烃基为乙基:-C2H5,其相对分子量为29,不满足条件,选项B错误;C.CH2BrCH2Br中烃基为-CH2CH2-,其相对分子量为28,不满足条件,选项C错误;D.CH3CHBrCH2Br中烃基为-CH(CH3)CH2-,其相对分子量为42,满足条件,,选项D正确;答案选D。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如图:

已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
(1)酸浸时,为了提高浸取率可采取的措施有________________(任写一种)。
(2)调节浸出液pH的范围为________,其目的是____________________。
(3)本工艺中可循环使用的物质是________(写化学式)。
(4)在该工艺的“加热驱氨”环节,若加热的温度较低或过高,都将造成__________的结果。
Ⅱ.海水开发利用的部分过程如下图所示。

(1)海水中提取的NaCl中若混有少量的KClO3固体(KClO3溶解度随温度变化大),可通过______、________、_________的操作净化。
(2)生成Mg(OH)2用的沉淀剂一般是生石灰或熟石灰,所以Mg(OH)2沉淀中会混有Ca(OH)2,可通过反复洗涤去除Ca(OH)2,检验沉淀是否洗净的操作方法_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各数值表示元素原子序数,在各组中能以离子键相互结合成稳定化合物的是( )
A. 10和19 B. 6和16 C. 11和17 D. 14和8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥ 浓HNO3,其中在一定条件下能与SiO2反应的有 ( )
A. ①②⑥ B. 全部 C. ①③④⑤ D. ②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X、Y、Z的结构简式如下表所示。下列说法正确的是
X | Y | Z | |
结构简式 |
|
|
|
A. X的分子式为C8H7O3
B. X、Y、Z均可以和FeCl3发生显色反应
C. X、Y互为同系物,X、Z互为同分异构体
D. X、Y、Z在一定条件下都能发生取代反应、加成反应和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成纳米氧化铜的重要前驱体之一,可采用苯乙腈(![]() )为原料在实验室进行合成。制备苯乙酸的装置如右图(加热和夹持仪器略去)。已知苯乙酸的熔点为76.5℃,微溶于冷水,易溶于乙醇。
)为原料在实验室进行合成。制备苯乙酸的装置如右图(加热和夹持仪器略去)。已知苯乙酸的熔点为76.5℃,微溶于冷水,易溶于乙醇。

在250mL三口瓶A中加入70mL质量分数为70%的硫酸和几片碎瓷片,加热至100℃,再缓缓滴入46.8g苯乙腈,然后升温至130℃,发生反应:
![]() +2H2O+H2SO4
+2H2O+H2SO4 +NH4HSO4
+NH4HSO4
请回答:
(1)甲同学提出为使反应物受热均匀,可以采取水浴加热。老师否定了这个建议,原因是_______。
(2)乙同学提出装置中缺少温度计,温度计水银球的合理位置是_______。
(3)本实验采用了滴液漏斗。与普通分液漏斗相比,滴液漏斗的优点是_______。
(4)反应结束后需先加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是_______,分离出苯乙酸的操作是_______。
(5)提纯粗苯乙酸最终得到19g纯品,则苯乙酸的产率是_____%(结果保留整数)。
(6)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后加入Cu(OH)2,搅拌30min,过滤。滤液静置一段时间可以析出苯乙酸铜晶体。此步骤中用到乙醇的作用是______;写出此步发生反应的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组溶液混合时,相互滴加的次序不同,现象也不同的是( )
A.氢氧化钠溶液与氯化铝溶液B.氢氧化钠溶液与盐酸
C.碳酸氢钠溶液与盐酸D.氢氧化钠溶液与氯化铁溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种物质的能量关系如下图所示。下列说法正确的是
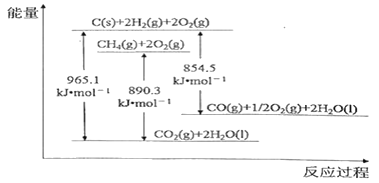
A. C(s)+O2(g)=CO2(g) △H =—965.1 kJ·mol-1
B. 2CO(g)+O2(g)=2CO2(g) △H =-221.2 kJ·mol-1
C. 由图可知,甲烷的燃烧热为779.7 kJ·mol-1
D. 通常由元素最稳定的单质生成生成1mol纯化合物时的反应热称为该化合物的标准生成焓,由图可知,CH4(g)的标准生成焓为+74.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
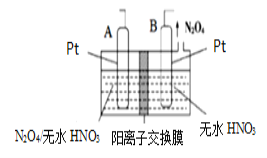
【题目】氮的氧化物种类较多,有N2O、NO、N2O3、NO2、N2O4、N2O5等,它们应用广泛。
(1)N2O是人类最早应用于医疗的麻醉剂之一。它可由NH4NO3在加热条件下分解产生,此反应的化学方程式为______________________________。
(2)N2O4可作火箭高能燃料N2H4的氧化剂。已知:2NO2(g)![]() N2O4(g)△H=﹣akJmol﹣1;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣bkJmol﹣1;N2(g)+2O2(g)=2NO2(g)△H=+ckJmol﹣1;(a、b、c均大于0)。写出气态肼(N2H4)在气态(N2O4)中燃烧生成氮气和气态水的热化学方程式________。
N2O4(g)△H=﹣akJmol﹣1;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣bkJmol﹣1;N2(g)+2O2(g)=2NO2(g)△H=+ckJmol﹣1;(a、b、c均大于0)。写出气态肼(N2H4)在气态(N2O4)中燃烧生成氮气和气态水的热化学方程式________。
(3)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压 × 物质的量分数[例如p(NO2)=p总×x(NO2)]。则反应2NO2(g)N2O4(g)△H=﹣akJmol﹣1平衡常数Kp表达式为______(用p总、和各气体物质的量分数x表示)。
(4)新型绿色硝化剂N2O5可以通过N2O4为原料用电解法制备,实验装置如图所示。则电极B接直流电源的___极,电解池中生成N2O5的电极反应式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com