
【题目】离子晶体是常见的晶体类型。请回答以下问题:
(1)离子晶体中阴阳离子半径之比是决定晶体构型的重要因素之一,配位数与离子半径之比存在如下关系:
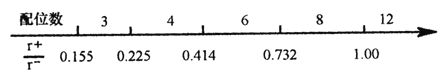
已知在某AB型离子化合物中,A+离子的半径为84pm,B-离子的半径为140pm。分析以上信息,与A+离子配位的所有B-离子,在空间构成的立体形状为_______。
(2)硫化亚铜和氧化亚铜均为离子晶体,其中熔点较高的为________ (填化学式),原因是________。
(3)向疏酸铜溶液中加入乙二胺(H2N-CH2-CH2-NH2)溶液后,每个Cu2+可与两个乙二胺分子形成四配位离子,导致溶液由蓝色变为紫色。该四配位离子的结构式为_______。
(4)K3C60是由足球烯(C60)与金属钾反应生成的盐。在K3C60晶胞中,C603-堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙,K+填充在空隙中。晶胞中被K+占据的空隙百分比为__________。
(5)H和Mg能形成一种离子型储氢材料,晶体结构如右图所示:
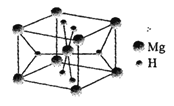
则该晶体中Mg的配位数是______,其化学式为________。已知该晶体的密度为ρg·cm-3,晶胞的体积为__________(用ρ、NA表示,其中NA表示阿伏加德罗常数的值)。
【答案】 正八面体 Cu2O 氧离子半径小于硫离子半径,Cu2O的晶格能大于Cu2S 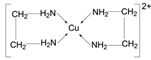 100% 6 MgH2
100% 6 MgH2 ![]()
![]()
【解析】(1) 在AB中,A+离子的半径为84pm,B-离子的半径为140pm,![]() ,从题给图中可知配位数为6,与氯化钠相同,已知NaCl中阴离子周围的6个阳离子在空间围成的立体形状为正八面体,同理AB晶体中与阴离子配位的6个阳离子在空间构成的立体形状为正八面体;(2) 因为氧离子半径小于硫离子半径,所以Cu2O的晶格能大于Cu2S,因此氧化亚铜的熔点比硫化亚铜的高;(3) 乙二胺(H2N-CH2-CH2-NH2)中N有孤电子对,Cu2+提供空轨道,根据信息每个Cu2+可与两个形成四配位离子,结构式为
,从题给图中可知配位数为6,与氯化钠相同,已知NaCl中阴离子周围的6个阳离子在空间围成的立体形状为正八面体,同理AB晶体中与阴离子配位的6个阳离子在空间构成的立体形状为正八面体;(2) 因为氧离子半径小于硫离子半径,所以Cu2O的晶格能大于Cu2S,因此氧化亚铜的熔点比硫化亚铜的高;(3) 乙二胺(H2N-CH2-CH2-NH2)中N有孤电子对,Cu2+提供空轨道,根据信息每个Cu2+可与两个形成四配位离子,结构式为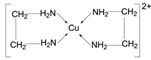 ;(4) C603-堆积方式为面心立方结构,位于顶点和面心,个数为8
;(4) C603-堆积方式为面心立方结构,位于顶点和面心,个数为8![]() ,根据化学式K3C60,K+的个数为12,K+位于空隙中,晶胞中被占据的空隙百分比为100%;(5)根据晶胞体心中的Mg原子可知,Mg的配位数是6;根据均摊法计算,晶胞中有8
,根据化学式K3C60,K+的个数为12,K+位于空隙中,晶胞中被占据的空隙百分比为100%;(5)根据晶胞体心中的Mg原子可知,Mg的配位数是6;根据均摊法计算,晶胞中有8![]() 个Mg,4
个Mg,4![]() 个H,故其化学式为MgH2;已知该晶体的密度为ρg·cm-3,晶胞的体积为V=
个H,故其化学式为MgH2;已知该晶体的密度为ρg·cm-3,晶胞的体积为V=![]() =
=![]() 。
。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:
【题目】下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥ 浓HNO3,其中在一定条件下能与SiO2反应的有 ( )
A. ①②⑥ B. 全部 C. ①③④⑤ D. ②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成纳米氧化铜的重要前驱体之一,可采用苯乙腈(![]() )为原料在实验室进行合成。制备苯乙酸的装置如右图(加热和夹持仪器略去)。已知苯乙酸的熔点为76.5℃,微溶于冷水,易溶于乙醇。
)为原料在实验室进行合成。制备苯乙酸的装置如右图(加热和夹持仪器略去)。已知苯乙酸的熔点为76.5℃,微溶于冷水,易溶于乙醇。

在250mL三口瓶A中加入70mL质量分数为70%的硫酸和几片碎瓷片,加热至100℃,再缓缓滴入46.8g苯乙腈,然后升温至130℃,发生反应:
![]() +2H2O+H2SO4
+2H2O+H2SO4 +NH4HSO4
+NH4HSO4
请回答:
(1)甲同学提出为使反应物受热均匀,可以采取水浴加热。老师否定了这个建议,原因是_______。
(2)乙同学提出装置中缺少温度计,温度计水银球的合理位置是_______。
(3)本实验采用了滴液漏斗。与普通分液漏斗相比,滴液漏斗的优点是_______。
(4)反应结束后需先加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是_______,分离出苯乙酸的操作是_______。
(5)提纯粗苯乙酸最终得到19g纯品,则苯乙酸的产率是_____%(结果保留整数)。
(6)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后加入Cu(OH)2,搅拌30min,过滤。滤液静置一段时间可以析出苯乙酸铜晶体。此步骤中用到乙醇的作用是______;写出此步发生反应的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组溶液混合时,相互滴加的次序不同,现象也不同的是( )
A.氢氧化钠溶液与氯化铝溶液B.氢氧化钠溶液与盐酸
C.碳酸氢钠溶液与盐酸D.氢氧化钠溶液与氯化铁溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A有如下的转化关系:

请结合上述转化关系回答问题:
(1)A的结构简式为_____;M是比A少一个CH2原子团的芳香族化合物,能发生银镜反应,且M在所有的同分异构体中核磁共振氢谱信号种类最少,则M的结构简式为_______。
(2)A→B的反应类型为_______。
(3)B→C的化学方程式为_______。
(4)C→E的化学方程式为_______ 。
(5)D、F的结构简式分别为_______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种物质的能量关系如下图所示。下列说法正确的是
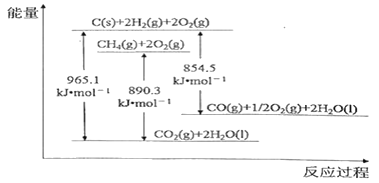
A. C(s)+O2(g)=CO2(g) △H =—965.1 kJ·mol-1
B. 2CO(g)+O2(g)=2CO2(g) △H =-221.2 kJ·mol-1
C. 由图可知,甲烷的燃烧热为779.7 kJ·mol-1
D. 通常由元素最稳定的单质生成生成1mol纯化合物时的反应热称为该化合物的标准生成焓,由图可知,CH4(g)的标准生成焓为+74.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用MgBr2稀溶液模拟从海水中制取无水氯化镁和溴单质,实验流程如下,下列说法不正确的是
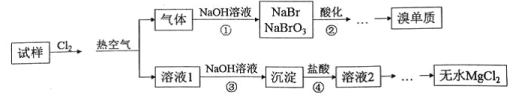
A. 步骤①中的NaOH溶液,可用Na2CO3、Na2SO3溶液代替
B. 步骤②可用硫酸酸化,发生的离子反应为5Br—+BrO3—+6H+=3Br2+3H2O
C. 步骤③包含过滤、洗涤等操作,可用AgNO3溶液检验是否洗涤干净
D. 经步骤③④,溶液1和溶液2的主要成份是相同的,但浓度上有较大差异
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,往一定量的NaOH固体中,逐滴加入1.00 mol·L1NH4HSO4溶液充分反应,反应产生的NH3随NH4HSO4溶液体积的变化如图所示(假设生成的NH3全部逸出),请计算:
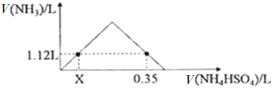
(1)X的值为______________。
(2)NaOH的物质的量为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com