
【题目】已知某有机物A有如下的转化关系:

请结合上述转化关系回答问题:
(1)A的结构简式为_____;M是比A少一个CH2原子团的芳香族化合物,能发生银镜反应,且M在所有的同分异构体中核磁共振氢谱信号种类最少,则M的结构简式为_______。
(2)A→B的反应类型为_______。
(3)B→C的化学方程式为_______。
(4)C→E的化学方程式为_______ 。
(5)D、F的结构简式分别为_______、_______。
【答案】 ![]()
![]() 氧化反应
氧化反应 ![]()
![]()
![]() 或
或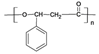
![]()
【解析】由C与碳酸钠反应生成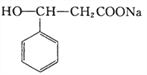 可知C为
可知C为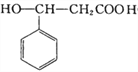 ,
, 在浓硫酸作用下加热反应生成能发生加聚反应的E,则E为
在浓硫酸作用下加热反应生成能发生加聚反应的E,则E为![]() ,F为
,F为![]() ,
, 发生缩聚反应生成D为
发生缩聚反应生成D为![]() ,C由B与氢气催化下反应生成,则B为
,C由B与氢气催化下反应生成,则B为![]() ,A与新制的氢氧化铜反应后酸化得到B,结合A的分子式可知,A为
,A与新制的氢氧化铜反应后酸化得到B,结合A的分子式可知,A为![]() 。(1)A的结构简式为
。(1)A的结构简式为![]() ;M是比A(
;M是比A(![]() )少一个CH2原子团的芳香族化合物,能发生银镜反应,且M在所有的同分异构体中核磁共振氢谱信号种类最少则M高度对称应该含有两个醛基,则M的结构简式为
)少一个CH2原子团的芳香族化合物,能发生银镜反应,且M在所有的同分异构体中核磁共振氢谱信号种类最少则M高度对称应该含有两个醛基,则M的结构简式为![]() ;(2)A→B是
;(2)A→B是![]() 与新制的氢氧化铜反应后酸化得到
与新制的氢氧化铜反应后酸化得到![]() ,反应类型为氧化反应;(3)B→C是
,反应类型为氧化反应;(3)B→C是![]() 与氢气发生加成反应生成
与氢气发生加成反应生成 ,反应的化学方程式为
,反应的化学方程式为![]() ;(4)C→E是
;(4)C→E是 在浓硫酸作用下生消去反应生成
在浓硫酸作用下生消去反应生成![]() 和水,反应的化学方程式为
和水,反应的化学方程式为![]() ;(5)D、F的结构简式分别为
;(5)D、F的结构简式分别为![]() 、
、![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式为 。下列关于苯佐卡因的叙述正确的是
。下列关于苯佐卡因的叙述正确的是
A. 分子式为C9H14NO2
B. 苯环上有2个取代基,且含有硝基的苯佐卡因的同分异构体有9种
C. 1mol该化合物最多与4mol氢气发生加成反应
D. 分子中将氨基转化成硝基的反应为氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧气可发生如下反应:P4+5O2=P4O10已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )

A. (4c+12b-6a-5d) kJ·mol-1 B. (6a+5d-4c-12b) kJ·mol-1
C. (4c+12b-4a-5d) kJ·mol-1 D. (4c+5d-4a-12b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由核电荷数1~18的某些元素组成的单质 A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示的转换关系,A是地壳中含量最多的金属元素。 请回答下列问题:
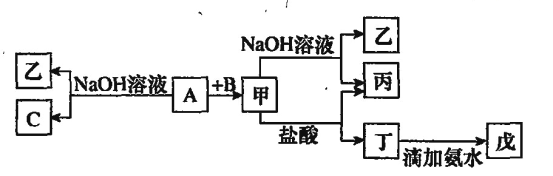
(1)写出下列物质的化学式:乙__________、丁__________、戊__________.
(2)写出甲物质在工业上的一种主要用途:__________。
(3)写出甲→乙+丙反应的离子方程式:__________。
(4)A→乙+C反应的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子晶体是常见的晶体类型。请回答以下问题:
(1)离子晶体中阴阳离子半径之比是决定晶体构型的重要因素之一,配位数与离子半径之比存在如下关系:
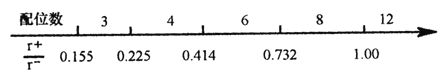
已知在某AB型离子化合物中,A+离子的半径为84pm,B-离子的半径为140pm。分析以上信息,与A+离子配位的所有B-离子,在空间构成的立体形状为_______。
(2)硫化亚铜和氧化亚铜均为离子晶体,其中熔点较高的为________ (填化学式),原因是________。
(3)向疏酸铜溶液中加入乙二胺(H2N-CH2-CH2-NH2)溶液后,每个Cu2+可与两个乙二胺分子形成四配位离子,导致溶液由蓝色变为紫色。该四配位离子的结构式为_______。
(4)K3C60是由足球烯(C60)与金属钾反应生成的盐。在K3C60晶胞中,C603-堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙,K+填充在空隙中。晶胞中被K+占据的空隙百分比为__________。
(5)H和Mg能形成一种离子型储氢材料,晶体结构如右图所示:
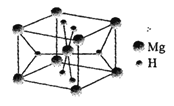
则该晶体中Mg的配位数是______,其化学式为________。已知该晶体的密度为ρg·cm-3,晶胞的体积为__________(用ρ、NA表示,其中NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质可以实现一步转化的是( )
A. N2→NO2→HNO3→NH4ClB. Al→Al2O3→Al(OH)3→AlCl3
C. Cu→CuCl2→Cu(OH)2→CuOD. Si→SiO2→H2SiO3→NaSiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CeO2通常既不溶于强酸,也不溶于强碱。某工厂以平板电视显示屏厂的废玻璃粉末(含CeO2、SiO2、Fe2O3、FeO等物质)为原料,设计如下图所示工艺流程,制得纯净的CeO2。下列说法正确的是( )
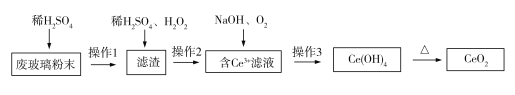
A. 实验室中,操作3和操作1、操作2所用仪器不同
B. 滤渣中加入稀H2SO4和H2O2,其中H2O2做氧化剂
C. 滤液中Ce3+与NaOH、O2的反应属于化合反应
D. 操作2分离得到的滤渣中一定含有未反应的SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式________________。
(2)若溶液M由10 mL 2 mol·L-1NaHA溶液与2 mol·L-1NaOH溶液等体积混合而成,则溶液M的pH________7(填“<”、“>”或“=”),溶液中离子浓度由大到小顺序为________________。已知常温下Ksp(BaA)=1.8×10-10,向该混合溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为__________ mol·L-1。
(3)若溶液M有下列三种情况:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为________;pH由大到小的顺序为_________________。
(4)若溶液M由pH=3的H2A溶液V1mL与pH=11的NaOH溶液V2mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为_________(填“大于”“小于”“等于”或“均有可能”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是

A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com