
【题目】已知CeO2通常既不溶于强酸,也不溶于强碱。某工厂以平板电视显示屏厂的废玻璃粉末(含CeO2、SiO2、Fe2O3、FeO等物质)为原料,设计如下图所示工艺流程,制得纯净的CeO2。下列说法正确的是( )
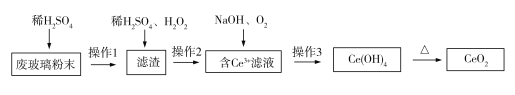
A. 实验室中,操作3和操作1、操作2所用仪器不同
B. 滤渣中加入稀H2SO4和H2O2,其中H2O2做氧化剂
C. 滤液中Ce3+与NaOH、O2的反应属于化合反应
D. 操作2分离得到的滤渣中一定含有未反应的SiO2
【答案】D
【解析】
由流程图可知,向玻璃粉末中加入稀硫酸,Fe2O3和FeO溶解,CeO2和SiO2不溶解,过滤得到的滤渣中含有CeO2和SiO2;向滤渣中加入稀H2SO4和H2O2,CeO2做氧化剂,被H2O2还原为Ce3+,过滤得到含Ce3+的滤液和含有SiO2的滤渣;滤液中Ce3+与NaOH、O2反应生成Ce(OH)4沉淀,过滤得到Ce(OH)4固体和硫酸钠溶液;Ce(OH)4固体加热分解得到CeO2。
根据上述分析可知,
A. 操作1、操作2和操作3都是过滤,所用仪器完全相同,A项错误;
B. CeO2与稀H2SO4和H2O2反应时,CeO2作氧化剂,H2O2作还原剂,B项错误;
C.Ce3+与NaOH、O2反应生成Ce(OH)4沉淀时,Ce3+作还原剂,O2作氧化剂,反应的离子方程式为:2Ce2(SO4)3+O2+12NaOH+2H2O![]() 4Ce(OH)4↓+6Na2SO4,该反应不属于化合反应,C项错误;
4Ce(OH)4↓+6Na2SO4,该反应不属于化合反应,C项错误;
D. SiO2是酸性氧化物,不与稀H2SO4反应,操作2分离得到的滤渣中主要成分是SiO2,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】对于A2 + 3B2![]() 2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
A.v(B2) =0.8mol(Ls)-1 B.v(A2) =0.4 mol(Ls)-1
C.v(C) =0.6 mol(Ls)-1 D.v(D) =0.1 mol(Ls)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成纳米氧化铜的重要前驱体之一,可采用苯乙腈(![]() )为原料在实验室进行合成。制备苯乙酸的装置如右图(加热和夹持仪器略去)。已知苯乙酸的熔点为76.5℃,微溶于冷水,易溶于乙醇。
)为原料在实验室进行合成。制备苯乙酸的装置如右图(加热和夹持仪器略去)。已知苯乙酸的熔点为76.5℃,微溶于冷水,易溶于乙醇。

在250mL三口瓶A中加入70mL质量分数为70%的硫酸和几片碎瓷片,加热至100℃,再缓缓滴入46.8g苯乙腈,然后升温至130℃,发生反应:
![]() +2H2O+H2SO4
+2H2O+H2SO4 +NH4HSO4
+NH4HSO4
请回答:
(1)甲同学提出为使反应物受热均匀,可以采取水浴加热。老师否定了这个建议,原因是_______。
(2)乙同学提出装置中缺少温度计,温度计水银球的合理位置是_______。
(3)本实验采用了滴液漏斗。与普通分液漏斗相比,滴液漏斗的优点是_______。
(4)反应结束后需先加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是_______,分离出苯乙酸的操作是_______。
(5)提纯粗苯乙酸最终得到19g纯品,则苯乙酸的产率是_____%(结果保留整数)。
(6)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后加入Cu(OH)2,搅拌30min,过滤。滤液静置一段时间可以析出苯乙酸铜晶体。此步骤中用到乙醇的作用是______;写出此步发生反应的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A有如下的转化关系:

请结合上述转化关系回答问题:
(1)A的结构简式为_____;M是比A少一个CH2原子团的芳香族化合物,能发生银镜反应,且M在所有的同分异构体中核磁共振氢谱信号种类最少,则M的结构简式为_______。
(2)A→B的反应类型为_______。
(3)B→C的化学方程式为_______。
(4)C→E的化学方程式为_______ 。
(5)D、F的结构简式分别为_______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种物质的能量关系如下图所示。下列说法正确的是
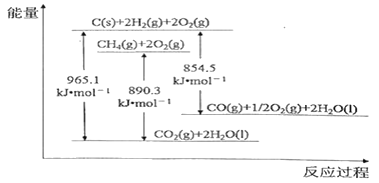
A. C(s)+O2(g)=CO2(g) △H =—965.1 kJ·mol-1
B. 2CO(g)+O2(g)=2CO2(g) △H =-221.2 kJ·mol-1
C. 由图可知,甲烷的燃烧热为779.7 kJ·mol-1
D. 通常由元素最稳定的单质生成生成1mol纯化合物时的反应热称为该化合物的标准生成焓,由图可知,CH4(g)的标准生成焓为+74.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X 、Y 和Z 在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1) X在元素周期表中的位置为_______;画出X的简单离子结构示意图_______。
已知X元素的一种原子,其中子数为10,写出这种原子的原子符号_____________。
(2)四种元素简单离子的半径由大到小为_____________(用离子符号表达)。
(3)W、X的最简单氢化物稳定性为_______>________(填化学式)。
(4)Z最高价氧化物的水化物与Y最高价氧化物对应水化物反应的化学方程式为______ 。
(5)ZX2气体是一种广谱杀菌消毒剂。工业上可利用NaZX3和NaZ 在酸性条件下制得ZX2 同时得到Z元素的单质,该反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用MgBr2稀溶液模拟从海水中制取无水氯化镁和溴单质,实验流程如下,下列说法不正确的是
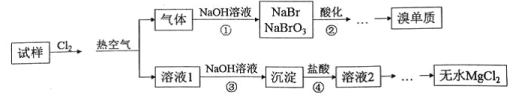
A. 步骤①中的NaOH溶液,可用Na2CO3、Na2SO3溶液代替
B. 步骤②可用硫酸酸化,发生的离子反应为5Br—+BrO3—+6H+=3Br2+3H2O
C. 步骤③包含过滤、洗涤等操作,可用AgNO3溶液检验是否洗涤干净
D. 经步骤③④,溶液1和溶液2的主要成份是相同的,但浓度上有较大差异
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4+6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察____________________。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由______色变成____________色。
(2)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010 mol/L,则该样品中氮的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa条件下,反应2N2O5(g)=4NO2(g)+O2(g) ΔH=+56.7 kJ·mol-1能自发进行的原因是( )
A. 该反应是吸热反应B. 该反应是放热反应
C. 该反应是熵减小的反应D. 该反应的熵增效应大于能量效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com