
【题目】标准状况下,往一定量的NaOH固体中,逐滴加入1.00 mol·L1NH4HSO4溶液充分反应,反应产生的NH3随NH4HSO4溶液体积的变化如图所示(假设生成的NH3全部逸出),请计算:
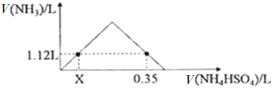
(1)X的值为______________。
(2)NaOH的物质的量为______________。
科目:高中化学 来源: 题型:
【题目】离子晶体是常见的晶体类型。请回答以下问题:
(1)离子晶体中阴阳离子半径之比是决定晶体构型的重要因素之一,配位数与离子半径之比存在如下关系:
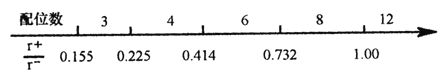
已知在某AB型离子化合物中,A+离子的半径为84pm,B-离子的半径为140pm。分析以上信息,与A+离子配位的所有B-离子,在空间构成的立体形状为_______。
(2)硫化亚铜和氧化亚铜均为离子晶体,其中熔点较高的为________ (填化学式),原因是________。
(3)向疏酸铜溶液中加入乙二胺(H2N-CH2-CH2-NH2)溶液后,每个Cu2+可与两个乙二胺分子形成四配位离子,导致溶液由蓝色变为紫色。该四配位离子的结构式为_______。
(4)K3C60是由足球烯(C60)与金属钾反应生成的盐。在K3C60晶胞中,C603-堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙,K+填充在空隙中。晶胞中被K+占据的空隙百分比为__________。
(5)H和Mg能形成一种离子型储氢材料,晶体结构如右图所示:
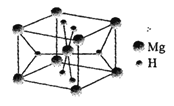
则该晶体中Mg的配位数是______,其化学式为________。已知该晶体的密度为ρg·cm-3,晶胞的体积为__________(用ρ、NA表示,其中NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。为测定某样品中AlN的含量,设计如下二种实验方案。(已知:样品中的杂质不与NaOH反应,且AlN+NaOH+3H2O═Na[Al(OH)4]+NH3↑)
(方案1)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
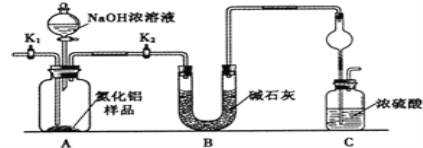
(1)如图C装置中球形干燥管的作用是______。
(2)完成以下实验步骤:组装好实验装置,首先______,再加入实验药品。接下来的实验操作是______,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是______。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见______。
(方案2)按以下步骤测定样品中AlN的纯度:
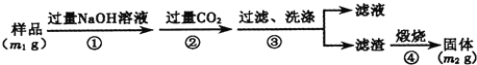
(4)步骤②生成沉淀的离子方程式为______。
(5)若在步骤③中未洗涤,测定结果将______(填“偏高”、“偏低”或“无影响”)。
(6)AlN的纯度为_____________(含m1,m2的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是(______)(填序号)。
A.Cl2 B.淡水 C.烧碱 D.食盐
(2)下图是从海水中提取镁的简单流程。

①操作A是 _______________________。
②无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为_____。
③海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?____。
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:

①灼烧海带至灰烬时所用的主要仪器名称是(________)(填序号)。
a.坩埚 b.试管 c.蒸发皿 d.烧杯
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式________________。
③用CCl4提取碘时除了用CCl4还可以选用的试剂是(________)(填字母序号)。
a.苯 b.乙醇 c.乙酸
④为检验用CCl4提取碘后的水溶液中是否还含有碘单质。请写出该实验的实验步骤、现象及结论:_______。
(4)利用海底的“可燃冰”制作的燃料电池的总反应式为CH4+2O2+2KOH = K2CO3+3H2O,则该燃料电池的负极的电极反应为__________________。
(5)海底的煤经综合利用开发的副产物CO2能生产甲醇燃料,其反应的方程式为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。某科学实验将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标。
CH3OH(g)+H2O(g)。某科学实验将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标。

①a点正反应速率_________(填“大于、等于或小于”)a点逆反应速率。
②平衡时CO2的物质的量浓度是___________mol/L。
③能够说明该反应达到化学平衡状态的标志是_______(双选)。
A.单位时间内消耗1molCO2,同时生成3mol H2
B.混合气体的密度不随时间变化
C.CH3OH、H2的浓度不再随时间变化
D.CH3OH和H2O浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的认识不正确的是
A. 油脂在空气中完全燃烧转化为水和二氧化碳
B. 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C. 在水溶液里,乙酸分子中的—CH3可以电离出H+
D. 在浓硫酸存在下,苯与浓硫酸共热生成硝基苯的反应属于取代反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是

A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见右图)。下列说法错误的是

A. a、b两处的混合气体成分含量相同,温度不同
B. c、d两处的混合气体成分含量相同,温度不同
C. 热交换器的作用是预热待反应的气体,冷却反应后的气体
D. c处气体经热交换后再次催化氧化的目的是提高SO2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向乙酸、乙醇、乙酸乙酯和水的平衡体系中加入少量含有18O的![]() ,达到新平衡后,体系中含有18O的物质是
,达到新平衡后,体系中含有18O的物质是
A. 乙酸、乙醇 B. 乙醇、乙酸乙酯
C. 乙醇、乙酸乙酯和水 D. 乙酸、乙醇、乙酸乙酯和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Murad等三位教授最早提出NO分子在人体内有独特功能,近年来此领域研究有很大进展,因此这三位教授获得了1998年诺贝尔医学奖及生理学奖。关于NO的下列叙述不正确的是( )
A. NO能够与人体血红蛋白结合,造成人体缺氧中毒
B. NO是汽车尾气的有害成分之一
C. NO在人体的血管系统内具有传送信号的功能
D. 常温下,N2和O2化合可得NO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com