
【题目】下列说法正确的是
A.按系统命名法![]() 的名称为2-甲基-3,5-二乙基己烷
的名称为2-甲基-3,5-二乙基己烷
B.用Na2CO3溶液能区分CH3COOH、CH3CH2OH、苯、硝基苯四种物质
C.等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗氧气的量依次增加
D.下列物质的沸点按由低到高顺序为:(CH3CH2)2CH3<(CH3)3CH<CH3(CH2)3CH3<(CH3)2CHCH2CH3
【答案】B
【解析】
A、按系统命名法,![]() 的名称为2,5-二甲基-3-乙基庚烷,A不正确;
的名称为2,5-二甲基-3-乙基庚烷,A不正确;
B、碳酸钠与乙酸反应生成CO2,与乙醇互溶,与苯、硝基苯不溶,但苯在上层,硝基苯在下层,因此用Na2 CO3溶液能区分CH3COOH、CH3CH2OH、苯、硝基苯四种物质,B正确;
C、在质量相等的条件下烃类燃烧消耗氧气的物质的量与有机物分子中氢元素的含量有关,氢元素的含量越高消耗的氧气越多。烃的最简式中CHn中n值越大,含氢量越高,消耗的氧气越多,所以等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗氧气的量依次减小,C不正确;
D、烷烃分子中碳原子数越多沸点越高。在碳原子数相同的条件下支链越多沸点越低,则下列物质的沸点按由低到高顺序为:(CH3)3CH<(CH3CH2)2CH3<(CH3)2CHCH2CH3<CH3(CH2)3CH3,D不正确;
答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)。
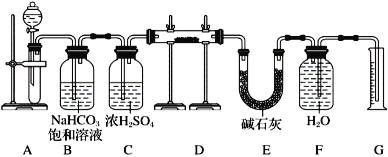
回答下列问题:
(1)连接好装置后需要进行的一步操作是:______,装置C的作用是________,装置E的作用是:____________。
(2)装置D中发生反应的化学方程式是__________、__________。
(3)若开始时测得样品的质量为2.2 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为______。(保留一位小数点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
a | b | c | |
① | Cu | CuO | Cu(OH)2 |
② | CH3CH2OH | CH3CHO | CH2=CH2 |
③ | S | SO3 | H2SO4 |
④ | NO | NO2 | HNO3 |
⑤ | FeCl2 | Fe | FeCl3 |

A. ②⑤ B. ③④ C. ④⑤ D. ①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氨基苯甲酸可用甲苯为原料合成,已知苯环上的硝基可被还原为氨基:![]() +3Fe+6HCl→
+3Fe+6HCl→![]() +3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )
+3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )
A.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
B.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
C.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
D.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1L含有0.400molCuSO4和0.200molKCl的水溶液,用惰性电极电解一段时间后,在一个电极上析出25.6gCu,此时在另一电极上放出的气体在标准状况下的体积为
A.5.60LB.6.72LC.4.48LD.3.36L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同质量的SO2、SO3的物质的量之比为___,所含氧原子的个数之比为____。
(2)相同条件下10mLA2气体与30mLB2气体恰好完全反应生成20mL某气体C,则C的化学式为____(用A、B表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中,反应A+2B![]() C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol·L-1、c(B)=0.200mol·L-1及c(C)=0mol·L-1,反应物A的浓度随时间的变化如图所示。下列说法不正确的是
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol·L-1、c(B)=0.200mol·L-1及c(C)=0mol·L-1,反应物A的浓度随时间的变化如图所示。下列说法不正确的是
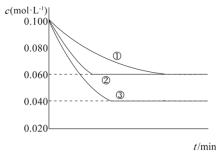
A.与①比较,②可能加入催化剂
B.与①比较,③可能是增大了压强
C.实验②平衡时B的转化率为40%
D.该反应的ΔH﹥0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下:
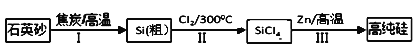
(1)1mol焦炭在过程Ⅰ中失去____mol电子。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的离子方程式为________。
(3)步骤(2)中的电解过程中,若用甲醇燃料电池作电源,用KOH作电解质,负极反应为_________。
(4)整过生产过程必须严格控制无水,回答下列问题:
①SiCl4遇水剧烈水解生成SiO2和一种酸,化学反应方程式为_________。
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是_________。
(5)Zn还原SiCl4的可逆反应如下:
SiCl4(g)+2Zn(s)![]() Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
A.还原过程需在无氧的气氛中进行 |
B.投入1molZn可生成14g还原产物 |
C.增加SiCl4(g)的量,该反应平衡常数不变 |
D.若SiCl4(g)过量可增大△H的值 |
(6)有一种由硅制作的材料中常加入Ag2SO4 ,已知某温度下Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ag2SO4的Ksp=_______(两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH=4的硫酸溶液分别稀释成原体积的10倍、100倍、10000倍。则稀释后溶液的pH分别为( )
A.5、6、8B.5、6、7C.4.7、6.7、8D.4.7、6.7、7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com