
某温度下,体积一定的密闭容器中进行如下可逆反应: X(g)+Y(g) Z(g)+W(s) △H>0下列叙述正确的是
Z(g)+W(s) △H>0下列叙述正确的是
A.加入少量W,逆反应速度增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.平衡后加入X,上述反应的△H增大
科目:高中化学 来源:2015-2016学年贵州省乌当区新天学校高二上学期期中测试化学试卷(解析版) 题型:?????
下列气体溶于水后,所得溶液呈碱性的是
A.CO2 B.HC1 C.NO2 D.NH3
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期期中阶段测试化学试卷(解析版) 题型:填空题
氧化还原反应是化学反应中的基本反应之一,研究氧化还原反应,对人类的进步具有极其重要的意义。
(1)已知:2BrO3﹣+C12=Br2+2C1O3﹣;
5C12+I2+6H2O=2HIO3+10HC1;
C1O3﹣+5C1﹣+6H+=3C12+3H2O
则C1O3﹣、BrO3﹣、IO3﹣、C12的氧化性由弱到强的排序为
(2)已知Fe3+的氧化性强于I2,请你从所给试剂中选择所需试剂,设计一个实验加以证明,(提示:请写出实验步骤、现象及结论)①FeCl3溶液 ②碘水 ③KI溶液 ④稀H2SO4 ⑤淀粉溶液 ;
(3)二十世纪初期,化学家合成出极易溶于水的NaBH4.在强碱性条件下,常用NaBH4处理含Au3+的废液生成单质Au,已知,反应后硼元素以BO2﹣形式存在,反应前后硼元素化合价不变,且无气体生成,则发生反应的离子方程式为
(4)某强氧化剂[RO(OH)2]+能将Na2SO3氧化.已知含2.0×10﹣3mol[RO(OH)2]+离子的溶液,恰好跟25.0mL 0.2mol/L 的Na2SO3溶液完全反应,则反应后R的化合价为 价;
(5)将32g 铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.请回答:
①待产生的气体全部释放后,向溶液加入V mL amol•L﹣1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L.(用含V、a的式子表示)
②欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%H202的质量为 g。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(解析版) 题型:选择题
已知反应2P(g)+Q(g) xW(g)+U(g),某温度下,将等物质的量的P与Q投入体积固定2L密闭容器中,经5min后到达平衡,5min内W的平均反应速率是0.2 mol·L-1•min-1,平衡时U的浓度为0.5 mol·L-1,[P]:[Q]=1:2,下列说法错误的是
xW(g)+U(g),某温度下,将等物质的量的P与Q投入体积固定2L密闭容器中,经5min后到达平衡,5min内W的平均反应速率是0.2 mol·L-1•min-1,平衡时U的浓度为0.5 mol·L-1,[P]:[Q]=1:2,下列说法错误的是
A.x值是2
B.P平衡转化率为66.7%
C.平衡常数为1
D.反应前,Q的物质的量为3 mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省宜昌市高一上学期期中测试化学试卷(解析版) 题型:选择题
某无色溶液中能够大量存在的离子是
A.K+ H+ SO42- OH-
B.Na+ Ca2+ CO32- NO3-
C.Mg2+ Fe3+ NO3- SO42-
D.Na+ Mg2+ Cl- SO42-
查看答案和解析>>
科目:高中化学 来源:2016届山东省潍坊市高三上学期期中测试化学试卷(解析版) 题型:选择题
下列描述与图像相对应的是

A.图①表示向乙酸溶液中通入氨气至过量的过程中溶液导电性的变化
B.图②表示向1 L l mol·L-1。FeBr2溶液中通入Cl2时Br-物质的量的变化
C.图③表示向Ca(HCO3)2溶液中滴加NaOH溶液时沉淀质量的变化
D.图④表示向一定浓度的Na2CO3溶液中滴加盐酸,生成CO2的物质的量与滴加盐酸物质的量的关系
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高一上学期期中测试化学试卷(解析版) 题型:选择题
根据下列反应判断有关物质还原性由强到弱的顺序是
①H2SO3+I2+H2O═2HI+H2SO4
②2FeCl3+2HI═2FeCl2+2HCl+I2
③3FeCl2+4HNO3═2FeCl3+NO↑+2H2O+Fe(NO3)3.
A.H2SO3>I﹣>Fe2+>NO
B.I﹣>Fe2+>H2SO3>NO
C.Fe2+>I﹣>H2SO3>NO
D.NO>Fe2+>H2SO3>I﹣
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二上学期期中测试化学试卷(解析版) 题型:选择题
可逆反应mA(s)+n D(g) pX(g)+qY(g)在反应过程中,其他条件不变,D的转化率和温度T或压强p关系如图所示(D﹪为D的转化率),下列叙述中正确的是
pX(g)+qY(g)在反应过程中,其他条件不变,D的转化率和温度T或压强p关系如图所示(D﹪为D的转化率),下列叙述中正确的是
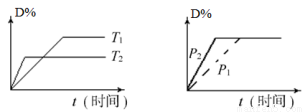
A.正反应为放热反应
B.使用催化剂,D的物质的量减小
C.化学方程式系数m+n=p+q
D.增加物质A或D的用量,平衡均向右移动
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期第二次月考化学试卷(解析版) 题型:实验题
亚硝酸钠被称为工业盐,不能用作食品工业,但在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。
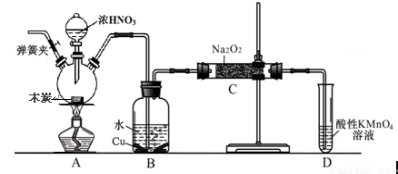
已知:室温下,①2NO+Na2O2 = 2NaNO2
②3NaNO2+3HCl == 3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2– 都能与MnO4–反应生成NO3– 和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式 。
(2)B中观察到的主要现象是有无色气体产生和 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的方法是 。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称 。
(5)将7.8g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com