
【题目】如图甲是利用一种微生物将废水中的尿素[CO(NH2)2] 的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜。下列说法中正确的是

A. 铜电极应与X相连接
B. M电极反应式:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+
C. 当N电极消耗0.25mol气体时,则铁电极增重16g
D. H+进过质子交换膜由右向左移动
【答案】B
【解析】甲图中装置是将化学能转化为电能的原电池,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应,A.铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极Y相连,故A错误;B CO(NH2)2在负极M上失电子发生氧化反应,生成氮气、二氧化碳和水,电极反应式为CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+,所以B选项是正确的;C.当N电极消耗0.25mol氧气时,则转移0.25![]() =1mol电子,所以铁电极增重
=1mol电子,所以铁电极增重![]() ,故C错误;D.M是负极,N是正极,质子透过离子交换膜由左M极移向右N极,即由左向右移动,故D错误.所以B选项是正确的.
,故C错误;D.M是负极,N是正极,质子透过离子交换膜由左M极移向右N极,即由左向右移动,故D错误.所以B选项是正确的.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:2CO2(g)+6H2(g)![]() CH3OCH3(g+3H2(g) △H
CH3OCH3(g+3H2(g) △H
已知:①CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.7kJ.mol-l
CH3OH(g) △H1=-90.7kJ.mol-l
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-23.5kJ.mol-l
CH3OCH3(g)+H2O(g) △H2=-23.5kJ.mol-l
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.2kJ.mol-l
CO2(g)+H2(g) △H2=-41.2kJ.mol-l
(1)△H_____ kJ.mol-l
(2)某温度下,在体积固定为2L的密闭容器中进行反应①,将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P前/P后) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则达到平衡时CO的转化率为_________。
(3)已知在某压强下,该反应在不同温度、不同投料比[n(H2)/n(CO2)]时,CO2的转化率如右图所示。从图中可得出三条主要规律:
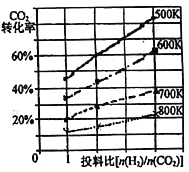
①增大投料比,CO2的转化率增大;②_____________;③_______________。
(4)反应③的v-t图像如图1所示,若其他条件不变,只是在反应前增大容器体积使压强减小,则其v-t图像如图2所示。
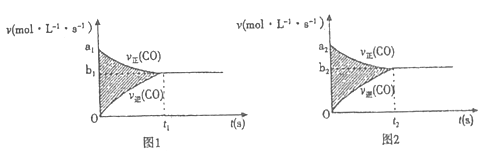
下列说法正确的是________。
①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦ t1<t2 ⑧两图中阴影部分面积相等⑨右图阴影部分面积更大 ⑩左图阴影部分面积更大
A. ①③⑦⑧ B. ①③⑤⑧ C. ②④⑦⑨ D. ①③⑦⑩
(5)由甲醇液相脱水法也可制二甲醚,首先将甲醇与浓硫酸反应生成硫酸氢甲酯(CH3OSO3H):CH3OH+H2SO4→CH3OSO3H+H2O;生成的硫酸氢甲酯再和甲醇反应生成二甲醚,第二步的反应方程式为:____________。与CO2和H2反应制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中I是一种高分子化合物,其合成路线如图:


已知:①![]()
②回答下列问题:
(1)A的名称为_______(系统命名法),G含有的官能团_____(写名称)。
(2)反应①的反应类型是________.
(3)I的结构简式为_____________________________;
(4)反应②的化学方程式为__________________________________。
(5)符合下列条件的G的同分异构体共有___________种。
①与G具有相同官能团; ②属于芳香族化合物
(6)参照上述合成路线,设计一条由乙醛、甲醇和J(E的同系物且相对分子质量比E小14)为主要原料(无机试剂任选)制备![]() 的合成路线______________。
的合成路线______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①菜籽油和氯化钠溶液 ②75%的医用酒精 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.过滤 萃取 分液
B.萃取 分液 蒸馏
C.分液 蒸馏 萃取
D.萃取 蒸馏 分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbO(溶于酸,微溶于强碱溶液)在工业上用途广泛,可制作颜料铅白、杀虫剂等。某再生能源企业以含铅废料(主要含Pb、PbO、PbSO4和极少量的PbO2)和稀H2SO4为原料制备高纯PbO的工艺流程如下:

(1)含铅废料中的PbO2和PbSO4中,铅的化合价分别为____________、____________。
(2)酸溶过程中为了加快溶解速率,除了加入FeSO4作催化剂外,还可采取的措施有____________________(任写一种)。
(3)滤液A中含有的主要阳离子是____________________(填离子符号)。
(4)脱硫过程发生的主要反应的离子方程式为________________________________。
(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,所用到的玻璃仪器有烧杯、_________和_________,检验沉淀是否洗涤干净的方法是________________________________。
(6)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。
NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在周期表中的位置关系如图。下列说法一定不正确的是
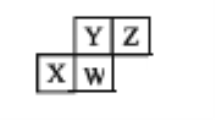
A. Z原子比X原子的最外层电子数多2个
B. 原子半径:W>X>Z>Y
C. 最高价氧化物对应的水化物的碱性:X>W
D. Y单质与氢气反应条件比Z单质更苛刻
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关说法错误的是
A.PVC(聚氯乙烯)包装袋不能用于食品包装
B.能生成有机高分子化合物的反应只有加聚反应
C.糖尿病人应少吃含糖的食品,即使是未加糖的八宝粥也要慎重食用
D.塑料、合成橡胶和合成纤维称为三大合成材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.从海水得到的粗食盐水中常含Ca2+、Mg2+、SO42-,需要分离提纯.现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂(1)盐酸、(2)Na2CO3、(3)NaOH、(4)BaCl2来除去食盐水中Ca2+、Mg2+、SO42-。提纯的操作步骤和加入试剂的情况如图1:

图中a、b、c、d分别表示上述4种试剂中的一种,试回答:
(1)生成沉淀A的化学方程式___________________________________;
(2)试剂d是________;判断试剂d已经足量的简单方法_______________________________;如果在加入d试剂前没有过滤,引起的后果是___________________________________。
(3)沉淀B、C、D的化学式分别为(不讲顺序)__________,_____________,____________;
(4)现有如图2仪器,过滤出沉淀A、B、C、D时必须用到______________(填序号)。

Ⅱ.海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定需要上述仪器中的_______________________(填序号);实验时②中除加入适量海水外,还需加入_____,其作用是_________________________。
Ⅲ.海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述中的仪器,该仪器名称为____________。为了使该仪器中液体可以顺利流下,应进行的具体操作是__________。向该碘水中加入四氯化碳以提取碘单质的实验操作为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com