
【题目】PbO(溶于酸,微溶于强碱溶液)在工业上用途广泛,可制作颜料铅白、杀虫剂等。某再生能源企业以含铅废料(主要含Pb、PbO、PbSO4和极少量的PbO2)和稀H2SO4为原料制备高纯PbO的工艺流程如下:

(1)含铅废料中的PbO2和PbSO4中,铅的化合价分别为____________、____________。
(2)酸溶过程中为了加快溶解速率,除了加入FeSO4作催化剂外,还可采取的措施有____________________(任写一种)。
(3)滤液A中含有的主要阳离子是____________________(填离子符号)。
(4)脱硫过程发生的主要反应的离子方程式为________________________________。
(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,所用到的玻璃仪器有烧杯、_________和_________,检验沉淀是否洗涤干净的方法是________________________________。
(6)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。
NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。

【答案】 -4 -2 将含铅废料粉碎(或加热等其他合理答案) H+、Fe2+ PbSO4+2OH-![]() PbO+SO42- +H2O 玻璃棒 漏斗 取最后一次的洗涤液。做焰色反应实验,火焰不变黄色(或取最后一次的洗涤液。滴入BaCl2溶液,若不产生白色沉淀),则说明已洗涤干净 将粗PbO溶解在一定量35%NaOH溶液中,加热至110℃左右,充分溶解后,趁热过滤,将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO
PbO+SO42- +H2O 玻璃棒 漏斗 取最后一次的洗涤液。做焰色反应实验,火焰不变黄色(或取最后一次的洗涤液。滴入BaCl2溶液,若不产生白色沉淀),则说明已洗涤干净 将粗PbO溶解在一定量35%NaOH溶液中,加热至110℃左右,充分溶解后,趁热过滤,将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO
【解析】(1)含铅废料中的PbO2和PhSO4中,铅的化合价分别为+4、 +2;(2)酸溶过程中为了加快溶解速率,除了加入FeSO4作催化剂外,还可采取的措施有将含铅废料粉碎、适当升高温度、适当增大酸的浓度等;(3) 含铅废料中加入硫酸亚铁和硫酸溶解,生成硫酸铅为滤渣,滤液A中含有过量的硫酸和硫酸亚铁,故主要阳离子是H+、Fe2+;(4)脱硫过程发生是将硫酸铅转化为PbO,主要反应的离子方程式为PbSO4+2OH-![]() PbO+SO42-+H2O;(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,所用到的玻璃仪器有烧杯、玻璃棒、漏斗,检验沉淀是否洗条干净的方法是取最后一次的洗涤液,做焰色反应实验,火焰不变黄色(或取最后一次白洗涤液.滴入BaCl2溶液,若不产生白色沉淀),则说明已洗涤干净;(6)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)
PbO+SO42-+H2O;(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,所用到的玻璃仪器有烧杯、玻璃棒、漏斗,检验沉淀是否洗条干净的方法是取最后一次的洗涤液,做焰色反应实验,火焰不变黄色(或取最后一次白洗涤液.滴入BaCl2溶液,若不产生白色沉淀),则说明已洗涤干净;(6)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq)PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作: 将粗PbO溶解在一定量35%NaOH溶液中,加热至110℃左右,充分溶解后,趁热过滤,将溶液冷却结晶,过滤、洗涤并干燥得到高纯PbO。
NaHPbO2(aq)PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作: 将粗PbO溶解在一定量35%NaOH溶液中,加热至110℃左右,充分溶解后,趁热过滤,将溶液冷却结晶,过滤、洗涤并干燥得到高纯PbO。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①标准状况下,0.2 mol任何物质的体积均为4.48 L
②若1 mol气体的体积为22.4 L,则它一定处于标准状况下
③标准状况下,1 LCO和1 L H2O的物质的量相同
④标准状况下,1 g H2和14 g N2的体积相同
⑤28 g CO的体积为22.4 L
⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑦在同温同体积时,气体物质的物质的量越大,则压强越大
⑧同温同压下,气体的密度与气体的相对分子质量成正比
A. ①②③④ B. ②③⑥⑦⑧ C. ④⑦⑧ D. ⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯在化工生产领域应用广泛。
(1)乙烯能合成很多有实用价值的有机物。

①试剂a是_____________。
②反应Ⅰ的反应类型是_____________。
(2)以原油为起始原料合成聚乙烯的路线如下图所示。

①聚乙烯的结构简式是_____________。
②写出分子式符合C4H10的有机物的结构简式_____________。
(3)已知:CH3CHO![]() CH3COOH。以CH2=CH2为起始原料,选用必要的无机试剂合成乙酸乙酯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
CH3COOH。以CH2=CH2为起始原料,选用必要的无机试剂合成乙酸乙酯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
①标准状况下,1LHCl和1LH2O的物质的量相同;
②标准状况下,11.2 LH2和14gN2所含原子数相同;
③28gCO 的体积约为22.4 L;
④两种物质的物质的量相同,则它们在标准状况下的体积相同;
⑤同温同体积时,气体物质的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比。
A. ⑤⑥ B. ②③⑤⑥ C. ②⑤⑥ D. ①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下0.1mol/L的NH4HCO3溶液pH =7.8, 已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是
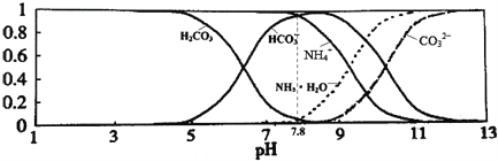
A. 溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
B. NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
C. 通过分析可知常温下 :Kb(NH3·H2O)<Ka1(H2CO3)
D. 在此溶液中滴加少量浓盐酸,溶液中c(CO32-) / c(HCO3-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)已知:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=﹣746.5kJ/mol
2CO2(g)+N2(g) △H=﹣746.5kJ/mol
2C(s)+O2(g)![]() 2CO(g) △H=﹣221 kJ/mol
2CO(g) △H=﹣221 kJ/mol
C(s)+O2(g)![]() CO2(g) △H=﹣393.5 kJ/mol
CO2(g) △H=﹣393.5 kJ/mol
则N2(g)+O2(g)═2NO(g) △H=____________ kJ/mol
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/10-4mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
c(CO)/10-3mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
则C2较合理的数值为_________(填字母标号)
A.4.20 B.4.00 C.2.95 D.2.85
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO2(g) ![]() CO2(g)+H2(g)得到如下三组数据:
CO2(g)+H2(g)得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | C | d | 1 |
若a=2,b=1,则c=____,三组实验对应平衡常数的关系K(i)_____ K(ii) _____ K(iii)(填“>”、“<”或“=”)。
(4)控制反应条件,CO和H2可以用来合成甲醇和二甲醚,其中合成二甲醚的化学方程式为:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g),在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比
CH3OCH3(g)+CO2(g),在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比![]() 的变化如图所示:
的变化如图所示:

①合成二甲醚的最佳氢碳比为__________。
②甲醇使用不当会导致污染,可用电解法消除这种污染。其原理是电解CoSO4、稀硫酸和CH3OH的混合溶液,将Co2+氧化为Co3+,Co3+再将CH3OH氧化成CO2,Co3+氧化CH3OH的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近有研究人员发现了一种处理高浓度乙醛废水的新方法一隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛—Na2SO4 溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。下列说法正确的是

A. 电解过程中,两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2
B. 阳极反应为CH3CHO-2e-+2H+=CH3COOH+H2O
C. 电解过程中,阴极区Na2SO4的物质的量增大
D. 若以CH4—空气燃料电池为直流电源,燃料电池的b 极应通入空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量是衡量一个国家石油化工水平的标志,乙烯有如下转化关系。
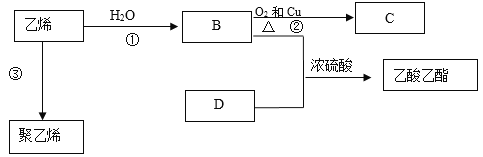
请回答下列问题:
(1)乙烯的结构简式为______。
(2)B所含官能团的名称为____________。
(3)③的反应类型是____________。
(4)浓硫酸的作用是________________。
(5)反应①的化学方程式为________________________________________________。
反应②的化学方程式为_____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com