
【题目】汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)已知:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=﹣746.5kJ/mol
2CO2(g)+N2(g) △H=﹣746.5kJ/mol
2C(s)+O2(g)![]() 2CO(g) △H=﹣221 kJ/mol
2CO(g) △H=﹣221 kJ/mol
C(s)+O2(g)![]() CO2(g) △H=﹣393.5 kJ/mol
CO2(g) △H=﹣393.5 kJ/mol
则N2(g)+O2(g)═2NO(g) △H=____________ kJ/mol
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/10-4mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
c(CO)/10-3mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
则C2较合理的数值为_________(填字母标号)
A.4.20 B.4.00 C.2.95 D.2.85
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO2(g) ![]() CO2(g)+H2(g)得到如下三组数据:
CO2(g)+H2(g)得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | C | d | 1 |
若a=2,b=1,则c=____,三组实验对应平衡常数的关系K(i)_____ K(ii) _____ K(iii)(填“>”、“<”或“=”)。
(4)控制反应条件,CO和H2可以用来合成甲醇和二甲醚,其中合成二甲醚的化学方程式为:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g),在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比
CH3OCH3(g)+CO2(g),在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比![]() 的变化如图所示:
的变化如图所示:

①合成二甲醚的最佳氢碳比为__________。
②甲醇使用不当会导致污染,可用电解法消除这种污染。其原理是电解CoSO4、稀硫酸和CH3OH的混合溶液,将Co2+氧化为Co3+,Co3+再将CH3OH氧化成CO2,Co3+氧化CH3OH的离子方程式为________________。
【答案】 +180.5 D 0.6 > = 1.0 6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
【解析】(1)已知:①2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=﹣746.5kJ/mol
2CO2(g)+N2(g) △H=﹣746.5kJ/mol
②2C(s)+O2(g)![]() 2CO(g) △H=﹣221 kJ/mol
2CO(g) △H=﹣221 kJ/mol
③C(s)+O2(g)![]() CO2(g) △H=﹣393.5 kJ/mol
CO2(g) △H=﹣393.5 kJ/mol
则依据盖斯定律,③×2-②-①得到:N2(g)+O2(g)=2NO(g)的△H=+180.5kJ/mol。
(2)由表中数据可知4s时反应到达平衡,1~3s内CO浓度变化量为3.05×10-3 mol/L-2.75×10-3 mol/L=3×10-4 mol/L,该2s内平均每秒内变化量为1.5×10-4 mol/L,随反应进行,反应速率减小,该2s中前1s内CO浓度变化量应大于1.5×10-4 mol/L,则2s时CO的浓度小于3.05×10-3 mol/L-1.5×10-4 mol/L=2.9×10-3 mol/L,故2s时CO的浓度应介于2.75×10-3 mol/L~2.9×10-3 mol/L之间,选项中只有2.85×10-3 mol/L符合,答案选D。
(3) H2O(g)+CO(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度(mol/L) 0.5 1 0 0
转化浓度(mol/L) 0.2 0.2 0.2 0.2
平衡浓度(mol/L) 0.3 0.8 0.2 0.2
H2O(g)+CO(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度(mol/L) 1 0.5 0 0
转化浓度(mol/L)0.5-c/2 0.5-c/2 d/2 d/2
平衡浓度(mol/L)0.5+c/2 c/2 d/2 d/2/span>
所以0.5-c/2=d/2,则d=1-c,由平衡常数相等可知:  ,解得c=0.6;650℃时根据方程式可知
,解得c=0.6;650℃时根据方程式可知
H2O(g)+CO(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度(mol/L) 1 2 0 0
转化浓度(mol/L) 0.8 0.8 0.8 0.8
平衡浓度(mol/L) 0.2 1.2 0.8 0.8
平衡常数为![]() >
>![]() ,又因为平衡常数只与温度有关系,则三组实验对应平衡常数的关系K(i)>K(ii)=K(iii)。
,又因为平衡常数只与温度有关系,则三组实验对应平衡常数的关系K(i)>K(ii)=K(iii)。
(4)①根据图像可知氢碳比为1时合成二甲醚的转化率最高,则合成二甲醚的最佳氢碳比为1。②根据电子得失守恒、原子守恒以及电荷守恒可知Co3+氧化CH3OH的离子方程式为6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。


科目:高中化学 来源: 题型:
【题目】根据反应2KClO3+I2=2KIO3+Cl2↑判断,下列结论不正确的是( )
A.I2具有还原性
B.该反应属于置换反应
C.氧化剂是KClO3
D.当生成1mol Cl2时,转移2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbO(溶于酸,微溶于强碱溶液)在工业上用途广泛,可制作颜料铅白、杀虫剂等。某再生能源企业以含铅废料(主要含Pb、PbO、PbSO4和极少量的PbO2)和稀H2SO4为原料制备高纯PbO的工艺流程如下:

(1)含铅废料中的PbO2和PbSO4中,铅的化合价分别为____________、____________。
(2)酸溶过程中为了加快溶解速率,除了加入FeSO4作催化剂外,还可采取的措施有____________________(任写一种)。
(3)滤液A中含有的主要阳离子是____________________(填离子符号)。
(4)脱硫过程发生的主要反应的离子方程式为________________________________。
(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,所用到的玻璃仪器有烧杯、_________和_________,检验沉淀是否洗涤干净的方法是________________________________。
(6)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。
NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ka 为平衡常数,pKa=﹣lgKa,25℃时,H2A的 pKa1 =1.85,pKa2=7.19。用 0.1mol·L-1NaOH溶液滴定20mL0.1mol·L-1H2A溶液的滴定曲线如下图所示(曲线上的数字为 pH)。下列说法不正确的是

A.a 点所得溶液中;2c(H2A)+c(A2-)=0.002mol
B.b 点所得溶液中:c(H2 A)+c(H+)=c(A2-)+C(OH-)
C.C 点所得溶液中:c(Na+)<3c(HA-)
D.d 点所得溶液中:c(Na+)>c(A2-)>c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有硫酸镁溶液500mL,它的密度是1.20g·cm3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是
A. 溶质的质量分数是24% B. 溶液的物质的量浓度是2.4mol·L1
C. 溶质和溶剂的物质的量之比约为1∶21.1 D. 硫酸根离子的质量是230.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。NOx主要来源于汽车尾气。
已知:N2(g)+O2(g)![]() 2NO(g) △H=+180.50 kJ·mol-1
2NO(g) △H=+180.50 kJ·mol-1
2CO(g)+O2(g)![]() 2 CO2(g) △H=-566.00kJ·mol-1
2 CO2(g) △H=-566.00kJ·mol-1
(1)汽车尾气转化器中发生的反应为:2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g),此反应的H =__________kJ·mol-1
N2(g) + 2CO2(g),此反应的H =__________kJ·mol-1
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0-15min)中NO的物质的量随时间变化的关系如下图一所示。
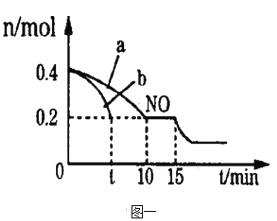
①T℃时该化学反应的平衡常数K=_______________;平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将_______移动。(填“向左”、“向右”或“不)
②图中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是__________(填“a”或“b”)。
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的一个条件可能是_____________________。
A.增大CO的浓度 B.升高温度 C.增大压强 D.恒容时充入He
(3)为探究温度及不同催化剂对反应2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g)的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得N2浓度变化情况如下图二所示。下列说法正确的是__________________ 。
N2(g) + 2CO2(g)的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得N2浓度变化情况如下图二所示。下列说法正确的是__________________ 。
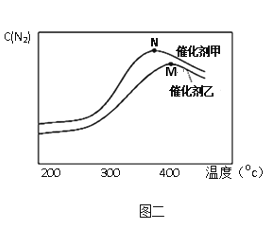
A.在相同温度下催化剂甲的作用下反应的平衡常数比催化剂乙时大
B.反应在M点达到平衡,此后N2浓度减小的原因可能是温度升高,平衡向左移动
C.N点后N2浓度减小的原因可能是温度升高发生了副反应
D.N点后N2浓度减小的原因可能是温度升高催化剂活性降低了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类或归类正确的一组是
①化合物:CaCl2、NaOH、HCl、HD ②混合物:盐酸、漂白粉、水玻璃、水银
③同素异形体:C60、金刚石、石墨 ④电解质:氯化铵、硫酸钡、冰醋酸
A.①② B.①③ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com