
����Ŀ���о�������NOx��SO2����������Ҫ�ɷ֡�NOx��Ҫ��Դ������β����
��֪��N2��g����O2��g��![]() 2NO��g�� ��H����180.50 kJ��mol��1
2NO��g�� ��H����180.50 kJ��mol��1
2CO��g����O2��g��![]() 2 CO2��g�� ��H����566.00kJ��mol��1
2 CO2��g�� ��H����566.00kJ��mol��1
��1������β��ת�����з����ķ�ӦΪ��2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g)���˷�Ӧ��H =__________kJ��mol��1
N2(g) + 2CO2(g)���˷�Ӧ��H =__________kJ��mol��1
��2��T��ʱ���������ʵ�����NO��CO�����ݻ�Ϊ2L���ܱ������У������¶Ⱥ�������䣬��Ӧ���̣�0��15min����NO�����ʵ�����ʱ��仯�Ĺ�ϵ����ͼһ��ʾ��
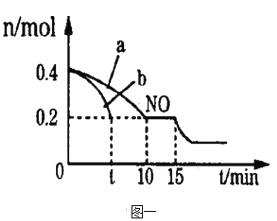
��T��ʱ�û�ѧ��Ӧ��ƽ�ⳣ��K��_______________��ƽ��ʱ�������¶Ȳ��䣬���������г���CO��N2��0.8mol��ƽ�⽫_______�ƶ���������������������������������
��ͼ��a��b�ֱ��ʾ��һ���¶��£�ʹ��������ͬ���������ͬ�Ĵ���ʱ���ﵽƽ�������n(NO)�ı仯���ߣ����б�ʾ����������ϴ��������__________������a������b������
��15minʱ�����ı���練Ӧ����������n(NO)������ͼ��ʾ�ı仯����ı��һ������������_____________________��
A������CO��Ũ�� B�������¶� C������ѹǿ D������ʱ����He
��3��Ϊ̽���¶ȼ���ͬ�����Է�Ӧ2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g)��Ӱ�죬�ֱ��ڲ�ͬ�¶ȡ���ͬ�����£�����������ʼ���������ظ�ʵ�飬����ͬʱ���ڲ��N2Ũ�ȱ仯�������ͼ����ʾ������˵����ȷ����__________________ ��
N2(g) + 2CO2(g)��Ӱ�죬�ֱ��ڲ�ͬ�¶ȡ���ͬ�����£�����������ʼ���������ظ�ʵ�飬����ͬʱ���ڲ��N2Ũ�ȱ仯�������ͼ����ʾ������˵����ȷ����__________________ ��
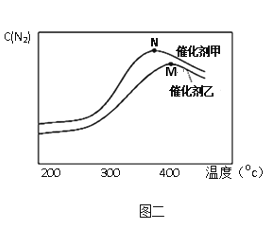
A������ͬ�¶��´����������·�Ӧ��ƽ�ⳣ���ȴ�����ʱ��
B����Ӧ��M��ﵽƽ�⣬�˺�N2Ũ�ȼ�С��ԭ��������¶����ߣ�ƽ�������ƶ�
C��N���N2Ũ�ȼ�С��ԭ��������¶����߷����˸���Ӧ
D��N���N2Ũ�ȼ�С��ԭ��������¶����ߴ������Խ�����
���𰸡� ��746.50 5L/mol ���� b AC CD
��������������������⿼���˹���ɵ�Ӧ�ã���ѧƽ�ⳣ���ļ����Ӧ������ѧƽ��ͼ��ķ�������������Ի�ѧ��Ӧ���ʺͻ�ѧƽ���Ӱ�졣
��1���Է�Ӧ��ţ�N2��g����O2��g��![]() 2NO��g����H����180.50 kJ/mol����ʽ��
2NO��g����H����180.50 kJ/mol����ʽ��
2CO��g����O2��g��![]() 2 CO2��g�� ��H����566.00 kJ/mol����ʽ��
2 CO2��g�� ��H����566.00 kJ/mol����ʽ��
Ӧ�ø�˹��������ʽ-��ʽ��2NO��g��+2CO��g��![]() N2��g��+2CO2��g����H=-566.00kJ/mol-��+180.50kJ/mol��=-746.50kJ/mol��
N2��g��+2CO2��g����H=-566.00kJ/mol-��+180.50kJ/mol��=-746.50kJ/mol��
��2������ͼ֪NO��ʼ���ʵ���Ϊ0.4mol��10~15minNO���ʵ������䣬˵��ƽ��ʱNO���ʵ���Ϊ0.2mol��������ʽ
2NO��g��+2CO��g��![]() N2��g��+2CO2��g��
N2��g��+2CO2��g��
c����ʼ����mol/L�� 0.2 0.2 0 0
c��ת������mol/L�� 0.1 0.1 0.05 0.1
c��ƽ�⣩��mol/L�� 0.1 0.1 0.05 0.1
�÷�Ӧ�Ļ�ѧƽ�ⳣ��K=![]() =
=![]() =5��L/mol���������������г���CO��N2��0.8mol��˲ʱCO��NO��N2��CO2���ʵ���Ũ������Ϊ0.5mol/L��0.1 mol/L��0.45 mol/L��0.1 mol/L����ʱŨ����Ϊ
=5��L/mol���������������г���CO��N2��0.8mol��˲ʱCO��NO��N2��CO2���ʵ���Ũ������Ϊ0.5mol/L��0.1 mol/L��0.45 mol/L��0.1 mol/L����ʱŨ����Ϊ![]() =1.8
=1.8![]() 5��ƽ�⽫�����ƶ���
5��ƽ�⽫�����ƶ���
����ͼ֪b�ﵽƽ������ʱ��̣�b��Ӧ���ʿ죬���������Խ��Ӧ����Խ�죬��ʾ����������ϴ��������b��
��A�����CO��Ũ�ȣ�ƽ��������Ӧ�����ƶ���NO���ʵ�����С����ȷ��B������¶ȣ�ƽ�����淴Ӧ�����ƶ���NO���ʵ���������C�����ѹǿ��ƽ��������Ӧ�����ƶ���NO���ʵ�����С����ȷ��D�����ʱ����He�����ڸ����ʵ�Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���NO���ʵ������䣬����ѡAC��
��3��A�ƽ�ⳣ��ֻ���¶��йأ�������أ�����ͬ�¶��´����������·�Ӧ��ƽ�ⳣ�����������������ȣ�����B�ͼ�����߱�ʾ������ͬʱ����N2Ũ�ȱ仯�����ͼ�������о������¶��������Ի�ѧ��Ӧ���ʵ�Ӱ�죬M����¶�������ͬʱ����N2Ũ�ȼ�С������N2�ķ�Ӧ���ʽ��ͣ��������¶����߷����˸���Ӧ���¶����ߴ������Խ��ͣ�������C�N��������¶���ͬʱ����N2Ũ�ȼ�С������N2�ķ�Ӧ���ʽ��ͣ��������¶����߷����˸���Ӧ����ȷ��D�N��������¶���ͬʱ����N2Ũ�ȼ�С������N2�ķ�Ӧ���ʽ��ͣ��������¶����ߴ����Ļ��Խ��ͣ��Ҵ�ʱ�����Է�Ӧ���ʵ�Ӱ��ռ�������ã���ȷ����ѡCD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.��֬������͵����ʶ��ܷ���ˮ�ⷴӦ
B.��֬������Ӧ��������������
C.������Һ�м������ᣬ����4��5 min���ټ�������������Һ�����ȣ��й�����������
D.����������ʹ�����ʷ������ԣ������ڽ��ƶ���걾
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����
�ٱ�״���£�1LHCl��1LH2O�����ʵ�����ͬ��
�ڱ�״���£�11.2 LH2��14gN2����ԭ������ͬ��
��28gCO �����ԼΪ22.4 L��
���������ʵ����ʵ�����ͬ���������ڱ�״���µ������ͬ��
��ͬ��ͬ���ʱ���������ʵ����ʵ���Խ����ѹǿԽ��
��ͬ��ͬѹ�£�������ܶ����������Է������������ȡ�
A. �ݢ� B. �ڢۢݢ� C. �ڢݢ� D. �٢ڢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���е���Ҫ��Ⱦ����NO��CO��Ϊ���������Ⱦ���������ͨ�����·�Ӧ����������β����
��1����֪��2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ��H=��746.5kJ/mol
2CO2(g)+N2(g) ��H=��746.5kJ/mol
2C(s)+O2(g)![]() 2CO(g) ��H=��221 kJ/mol
2CO(g) ��H=��221 kJ/mol
C(s)+O2(g)![]() CO2(g) ��H=��393.5 kJ/mol
CO2(g) ��H=��393.5 kJ/mol
��N2(g)+O2(g)�T2NO(g) ��H=____________ kJ/mol
��2��T���£���һ�ݻ�������ܱ������У�ͨ��һ������NO��CO�������崫������ò�ͬʱ��NO��CO��Ũ�����±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
c��NO��/10-4mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
c��CO��/10-3mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
��C2�Ϻ�������ֵΪ_________������ĸ��ţ�
A.4.20 B.4.00 C.2.95 D.2.85
��3������ͬ���ʵ�����H2O(g)��CO(g)�ֱ�ͨ�����Ϊ2L�ĺ����ܱ������У����з�Ӧ��H2O(g)+CO2(g) ![]() CO2(g)+H2(g)�õ������������ݣ�
CO2(g)+H2(g)�õ������������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | C | d | 1 |
��a=2��b=1����c=____������ʵ���Ӧƽ�ⳣ���Ĺ�ϵK(i)_____ K(ii) _____ K(iii)�����������������=������
��4�����Ʒ�Ӧ������CO��H2���������ϳɼ״��Ͷ����ѣ����кϳɶ����ѵĻ�ѧ����ʽΪ��3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)������ͬ�����ºϳɶ����Ѻͺϳɼ״���ԭ��ƽ��ת��������̼��
CH3OCH3(g)+CO2(g)������ͬ�����ºϳɶ����Ѻͺϳɼ״���ԭ��ƽ��ת��������̼��![]() �ı仯��ͼ��ʾ��
�ı仯��ͼ��ʾ��

�ٺϳɶ����ѵ������̼��Ϊ__________��
�ڼ״�ʹ�ò����ᵼ����Ⱦ�����õ�ⷨ����������Ⱦ����ԭ���ǵ��CoSO4��ϡ�����CH3OH�Ļ����Һ����Co2+����ΪCo3+��Co3+�ٽ�CH3OH������CO2��Co3+����CH3OH�����ӷ���ʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����
��1����ԭ�ӵĽṹʾ��ͼΪ_____________________��
��2��![]() �����������_______����������_______�������������_______��
�����������_______����������_______�������������_______��
��3��49g��������ʵ���Ϊ________mol������ȫ�������H+�ĸ���Ϊ___________��
��4��V L Al2(SO4)3��Һ�У�����a g Al3+������Һ��Al3+�����ʵ���Ũ��_________��SO42�� ���ʵ���Ũ��__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������о���Ա������һ�ִ�����Ũ����ȩ��ˮ���·���һ��Ĥ��ⷨ����ȩ�ֱ�����������������Ӧ��ת��Ϊ�Ҵ������ᡣʵ������һ��Ũ�ȵ���ȩ��Na2SO4 ��ҺΪ�������Һ��ģ����ȩ��ˮ�Ĵ������̣���װ����ͼ��ʾ������˵����ȷ����

A. �������У��������ֱ�����������Ҵ��⣬����������ɫ���壬��������������O2
B. ������ӦΪCH3CHO-2e-+2H+=CH3COOH+H2O
C. �������У�������Na2SO4�����ʵ�������
D. ����CH4������ȼ�ϵ��Ϊֱ����Դ��ȼ�ϵ�ص�b ��Ӧͨ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����2H2(g)��O2(g)= 2H2O(g)����H����483.6 kJ��mol��1
��H2(g) �� S(g) = H2S(g)����H����20.1 kJ��mol��1 �������ж�һ����ȷ����
A. 1 mol������ȫȼ������H2O(g)����241.8 kJ����
B. ˮ������������������221.7 kJ
C. �ɢ٢�֪��ˮ�����ȶ���С������
D. ��Ӧ���и��ù�̬��1 mol H2��ȫ��Ӧ���Ƚ�С��20.1 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ��ص�����ת�����ڣ� ��
A. ����ת��Ϊ��ѧ�� B. ��ѧ��ת��Ϊ��ѧ��
C. ��ѧ��ת��Ϊ���� D. ����ת��Ϊ��е��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���п��淴ӦFe(s)+CO2(g) ![]() FeO(s) + CO(g)����֪���¶�938Kʱ��ƽ�ⳣ��K=1.5����1173Kʱ��K=2.2 ��
FeO(s) + CO(g)����֪���¶�938Kʱ��ƽ�ⳣ��K=1.5����1173Kʱ��K=2.2 ��
��1�����жϸ÷�Ӧ�ﵽƽ��״̬��������__________��˫ѡ������ţ���
A��������ѹǿ������ B��c��CO��������
C��v����CO2��=v����CO�� D��c��CO2��=c��CO��
��2���÷�Ӧ������Ӧ��_________��ѡ������������������������Ӧ��
��3��д���÷�Ӧ��ƽ�ⳣ������ʽ__________������ʼʱ��Fe��CO2��������̶����ܱ������У�CO2����ʼŨ��Ϊ2.0mol/L��ij�¶�ʱ�ﵽƽ�⣬��ʱ������CO��Ũ��Ϊ1.0 mol/L������¶���������Ӧ��ƽ�ⳣ��K=__________��������λ��Ч���֣���
��4�����÷�Ӧ������̶����ܱ������н��У���һ�������´ﵽƽ��״̬������ı�������������Ӧ���������CO2�����ʵ���������α仯��ѡ����������������С����������������
�������¶�__________������ͨ��CO___________��
��5���÷�Ӧ���淴Ӧ������ʱ��仯�Ĺ�ϵ����ͼ��

�ٴ�ͼ�п�������Ӧ��t2ʱ��ƽ�⣬ ��t1ʱ�ı���ij���������ı�����������ǣ�����ţ�___________������ѡ��
A������ B������CO2Ũ��
�������t3ʱ�ӻ�����з��������CO��t4~ t5ʱ��η�Ӧ������ƽ��״̬������ͼ�ϻ���t3~ t5��V���棩�仯����______________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com