
【题目】最近有研究人员发现了一种处理高浓度乙醛废水的新方法一隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛—Na2SO4 溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。下列说法正确的是

A. 电解过程中,两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2
B. 阳极反应为CH3CHO-2e-+2H+=CH3COOH+H2O
C. 电解过程中,阴极区Na2SO4的物质的量增大
D. 若以CH4—空气燃料电池为直流电源,燃料电池的b 极应通入空气
【答案】A
【解析】A. 电解过程中,阳极反应为4OH--4e-═O2↑+2H2O、CH3CHO-2e-+H2O=CH3COOH+2H+,阴极反应为4H++4e-=2H2↑、CH3CHO+2e-+2H2O═CH3CH2OH+2OH-,两极除分别生成乙酸和乙醇外,均产生了无色气体,阳极产生的是O2,阴极产生的是H2,故A正确;B. 阳极反应为CH3CHO -2e-+ H2O = CH3COOH +2H+,故B错误;C. 电解过程中,阴极区SO42-的物质的量不变,所以Na2SO4的物质的量不变,故C错误;D. 若以CH4一空气燃料电池为直流电源,燃料电池的b极是负极,应通入甲烷,故D错误。故选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下氢氧化锌在碱性溶液中的变化如图所示,横坐标为溶液的pH,纵坐标为Zn2+或Zn022-的物质的量浓度的对数,下列说法正确的是
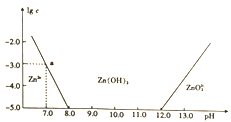
A. 依图中数据计算可得该温度下Zn(OH)2的溶度积(Ksp)=1×10-17
B. 溶液中加入足量氨水,发生反应的离子方程式为Zn2++40H-=ZnO22-+2H2O
C. 为提取工业废液中的Zn2+,可以控制溶液的pH在13左右
D. Zn2+在溶液中的存在形式与Al3+相似,碱性溶液中只以Zn(OH)2形式存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbO(溶于酸,微溶于强碱溶液)在工业上用途广泛,可制作颜料铅白、杀虫剂等。某再生能源企业以含铅废料(主要含Pb、PbO、PbSO4和极少量的PbO2)和稀H2SO4为原料制备高纯PbO的工艺流程如下:

(1)含铅废料中的PbO2和PbSO4中,铅的化合价分别为____________、____________。
(2)酸溶过程中为了加快溶解速率,除了加入FeSO4作催化剂外,还可采取的措施有____________________(任写一种)。
(3)滤液A中含有的主要阳离子是____________________(填离子符号)。
(4)脱硫过程发生的主要反应的离子方程式为________________________________。
(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,所用到的玻璃仪器有烧杯、_________和_________,检验沉淀是否洗涤干净的方法是________________________________。
(6)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。
NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有硫酸镁溶液500mL,它的密度是1.20g·cm3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是
A. 溶质的质量分数是24% B. 溶液的物质的量浓度是2.4mol·L1
C. 溶质和溶剂的物质的量之比约为1∶21.1 D. 硫酸根离子的质量是230.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。NOx主要来源于汽车尾气。
已知:N2(g)+O2(g)![]() 2NO(g) △H=+180.50 kJ·mol-1
2NO(g) △H=+180.50 kJ·mol-1
2CO(g)+O2(g)![]() 2 CO2(g) △H=-566.00kJ·mol-1
2 CO2(g) △H=-566.00kJ·mol-1
(1)汽车尾气转化器中发生的反应为:2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g),此反应的H =__________kJ·mol-1
N2(g) + 2CO2(g),此反应的H =__________kJ·mol-1
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0-15min)中NO的物质的量随时间变化的关系如下图一所示。
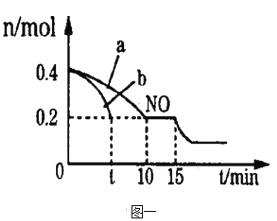
①T℃时该化学反应的平衡常数K=_______________;平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将_______移动。(填“向左”、“向右”或“不)
②图中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是__________(填“a”或“b”)。
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的一个条件可能是_____________________。
A.增大CO的浓度 B.升高温度 C.增大压强 D.恒容时充入He
(3)为探究温度及不同催化剂对反应2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g)的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得N2浓度变化情况如下图二所示。下列说法正确的是__________________ 。
N2(g) + 2CO2(g)的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得N2浓度变化情况如下图二所示。下列说法正确的是__________________ 。
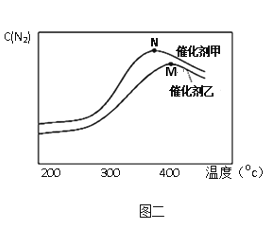
A.在相同温度下催化剂甲的作用下反应的平衡常数比催化剂乙时大
B.反应在M点达到平衡,此后N2浓度减小的原因可能是温度升高,平衡向左移动
C.N点后N2浓度减小的原因可能是温度升高发生了副反应
D.N点后N2浓度减小的原因可能是温度升高催化剂活性降低了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下提到的与盐的水解有关的说法是( )
①明矾可以做净水剂 ②实验室配制FeCl3溶液时,往往在FeCl3溶液中加入少量盐酸
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂 ④在NH4Cl溶液中加入金属镁会产生氢气
⑤草木灰与氨态氮肥不能混合施用 ⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性
A. ①③⑥ B. ②③⑤ C. ③④⑤ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类或归类正确的一组是
①化合物:CaCl2、NaOH、HCl、HD ②混合物:盐酸、漂白粉、水玻璃、水银
③同素异形体:C60、金刚石、石墨 ④电解质:氯化铵、硫酸钡、冰醋酸
A.①② B.①③ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓与ⅤA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs)。回答下列问题:
(1)基态Ga原子的核外电子排布式为__________,基态As原子核外有__________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为__________和+3。砷的电负性比镓__________(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:__________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是_______________________________________。
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为__________,草酸根中碳原子的杂化方式为__________。

(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm,该晶体的类型为__________,晶体的密度为__________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,吸收的热量用于克服分子间作用力的是( )
A. 加热氯化钠使之熔化 B. 加热二氧化硅使之熔化
C. 液溴受热变成溴蒸气 D. 加热碘化氢使之分解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com