
【题目】下列说法正确的是
A.油脂、糖类和蛋白质都能发生水解反应
B.油脂皂化反应可用硫酸作催化剂
C.淀粉溶液中加入硫酸,加热4~5 min,再加入少量银氨溶液,加热,有光亮银镜生成
D.福尔马林能使蛋白质发生变性,可用于浸制动物标本
科目:高中化学 来源: 题型:
【题目】铝箔在酒精灯上加热至熔化的实验现象与下列性质的叙述无关的是( )
A. 铝表面可形成一层氧化物保护膜
B. 铝的熔点较低
C. Al2O3熔点高,酒精灯不能将其熔化
D. 铝能与酸或强碱溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种固体物质溶解度曲线如图所示。请回答:
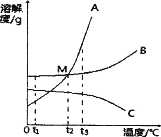
(1)图中M点表示_________________;
(2)t3℃时A、B、C三种物质的溶解度由小到大的顺序是____________;
(3)现有t1℃时A、B、C的三种饱和溶液,分别将它们升温到t3℃,溶质的质量分数由大到小的顺序是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 常温常压下,48g O3含有的氧原子数为3NA
B. 标准状况下,22.4L Cl2与足量的Fe反应转移的电子数为3NA
C. 已知可逆反应:2NO2![]() N2O4,将2molNO2放入反应容器中,生成的N2O4的物质的量一定是1mol
N2O4,将2molNO2放入反应容器中,生成的N2O4的物质的量一定是1mol
D. 58.5gNaCl固体溶于1L的水中,所得溶液的物质的量浓度为1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下氢氧化锌在碱性溶液中的变化如图所示,横坐标为溶液的pH,纵坐标为Zn2+或Zn022-的物质的量浓度的对数,下列说法正确的是
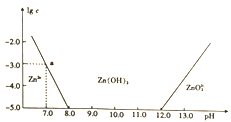
A. 依图中数据计算可得该温度下Zn(OH)2的溶度积(Ksp)=1×10-17
B. 溶液中加入足量氨水,发生反应的离子方程式为Zn2++40H-=ZnO22-+2H2O
C. 为提取工业废液中的Zn2+,可以控制溶液的pH在13左右
D. Zn2+在溶液中的存在形式与Al3+相似,碱性溶液中只以Zn(OH)2形式存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。消除汽车尾气中的NO、CO,有利于减少PM2.5 的排放。已知如下信息:
①2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H1=- 748kJ/mol
2CO2(g)+N2(g) △H1=- 748kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-565kJ/mol
(1)在一定条件下N2和O2会转化为NO,写出该反应的热化学方程式:______________。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L 恒容密闭容器中加入0.2moINO 和0.3moICO,在催化剂存在的条件下发生反应①,10min 时反应达到平衡,测得10min 内v(NO)=7.5×10-3mol/(Lmin),则平衡后CO 的转化率为_______________。
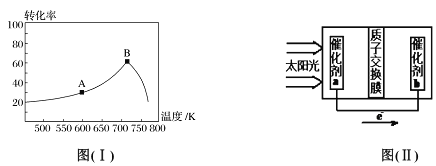
(3)其他条件相同,t min 时不同温度下测得NO 的转化率如图( I)所示。A 点的反应速率v正___(填“>”、“<”或“=”)v逆,A、B两点反应的平衡常数较大的是_______(填“A”或“B”),理由是__________________。
(4)已知常温下: Ka(HNO2)=7.1×10-4mol/L;Kb(NH3·H2O)=1.7×10-5mol/L。0.1mol/LNH4NO2溶液中离子浓度由大到小的顺序是_________,常温下NO2-水解反应的平衡常数K=____。
(5)人工光合作用能够借助太阳能用CO2和水制备化学原料,图(II )是通过人工光合作用制备HCOOH 的原理示意图,请写出催化剂b处的电极反应式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应2KClO3+I2=2KIO3+Cl2↑判断,下列结论不正确的是( )
A.I2具有还原性
B.该反应属于置换反应
C.氧化剂是KClO3
D.当生成1mol Cl2时,转移2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。NOx主要来源于汽车尾气。
已知:N2(g)+O2(g)![]() 2NO(g) △H=+180.50 kJ·mol-1
2NO(g) △H=+180.50 kJ·mol-1
2CO(g)+O2(g)![]() 2 CO2(g) △H=-566.00kJ·mol-1
2 CO2(g) △H=-566.00kJ·mol-1
(1)汽车尾气转化器中发生的反应为:2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g),此反应的H =__________kJ·mol-1
N2(g) + 2CO2(g),此反应的H =__________kJ·mol-1
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0-15min)中NO的物质的量随时间变化的关系如下图一所示。
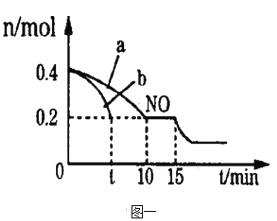
①T℃时该化学反应的平衡常数K=_______________;平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将_______移动。(填“向左”、“向右”或“不)
②图中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是__________(填“a”或“b”)。
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的一个条件可能是_____________________。
A.增大CO的浓度 B.升高温度 C.增大压强 D.恒容时充入He
(3)为探究温度及不同催化剂对反应2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g)的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得N2浓度变化情况如下图二所示。下列说法正确的是__________________ 。
N2(g) + 2CO2(g)的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得N2浓度变化情况如下图二所示。下列说法正确的是__________________ 。
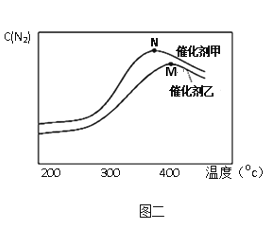
A.在相同温度下催化剂甲的作用下反应的平衡常数比催化剂乙时大
B.反应在M点达到平衡,此后N2浓度减小的原因可能是温度升高,平衡向左移动
C.N点后N2浓度减小的原因可能是温度升高发生了副反应
D.N点后N2浓度减小的原因可能是温度升高催化剂活性降低了
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com