
【题目】铝箔在酒精灯上加热至熔化的实验现象与下列性质的叙述无关的是( )
A. 铝表面可形成一层氧化物保护膜
B. 铝的熔点较低
C. Al2O3熔点高,酒精灯不能将其熔化
D. 铝能与酸或强碱溶液反应
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界中,回答下列问题:
(1) 碳在形成化合物时,其键型以共价键为主,原因是___________________________。
(2) (CN)2分子中,共价键的类型有________________,C原子的杂化轨道类型是____________
(3) CO能与金属Fe形成Fe(CO)5,该化合物熔点为253K,沸点为376K,其固体属于________晶体。
(4) 与碳同族的基态Ge原子的核外电子排布式为___________,有________个未成对电子。
(5) 石墨可用作锂离子电池的负极材料,充电时发生下述反应:Li1-xC6+xLi++xe→LiC6。其结果是:Li+嵌入石墨的A、B层间。现有某石墨嵌入化合物每个六元环都对应一个Li+,写出它的化学式:_______。

(6) 碳有多种同素异形体,其中金刚石的晶体晶胞如下图所示:
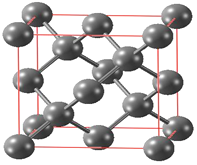
已知金刚石立方晶胞边长a pm,请计算晶体密度____________g/cm3(请用含a和NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属晶体判断正确的是
A.简单立方、配位数6、空间利用率68%
B.钾型、配位数6、空间利用率68%
C.镁型、配位数8、空间利用率74%
D.铜型、配位数12、空间利用率74%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质能与H2反应,反应情况如下表所示:
F2 | 在暗处能剧烈化合并发生爆炸,生成的氟化氢很稳定 |
Cl2 | 光照或点燃发生反应,生成的氯化氢较稳定 |
Br2 | 加热至一定温度才能反应,生成的溴化氢不如氯化氢稳定 |
I2 | 不断加热才能缓慢反应,同一条件下,生成的HI会分解 |
(1)卤族元素位于周期表中的_________族。
(2)用电子式表示HCl的形成过程________。
(3)依据上表,可以推测出:随着核电荷数的增加,________(填字母)。
a. 单质的熔沸点逐渐升高 b. 元素的非金属性逐渐减弱
c. 卤化氢的还原性依次减弱 d. 卤化氢的稳定性依次减弱
(4)I2与H2反应的化学方程式是________。
(5)不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近。BrCl和FeCl2水溶液发生反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的短周期主族元素,W、X处于不同周期,原子的最外层电子数X比Y多一个但比Z少一个,原子的电子层数X比Y、Z少一层。下列说法正确的是
A. 原子半径的大小为:Z>Y>X>W
B. 若Y、Z的核电荷数之和为X的4倍,则X、Z的气态氢化物的沸点:前者低于后者
C. 元素的非金属性:Y>Z
D. 若X的单质为常见的非金属导体,则Y的简单离子能破坏水的电离平衡
【答案】D
【解析】根据题意W是H元素;X、Y、Z在元素周期表的相对位置是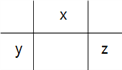 ;原子半径的大小为:Y>Z>X>W,故A错误;若Y、Z的核电荷数之和为X的4倍,则X、Z分别是O、Cl,的气态氢化物的沸点:H2O>HCl,故B错误;同周期元素从左到右非金属性增强,元素的非金属性:Y<Z,故C错误;若X的单质为常见的非金属导体,X是碳元素, Y是Al元素,Al3+水解促进水的电离,故D正确。
;原子半径的大小为:Y>Z>X>W,故A错误;若Y、Z的核电荷数之和为X的4倍,则X、Z分别是O、Cl,的气态氢化物的沸点:H2O>HCl,故B错误;同周期元素从左到右非金属性增强,元素的非金属性:Y<Z,故C错误;若X的单质为常见的非金属导体,X是碳元素, Y是Al元素,Al3+水解促进水的电离,故D正确。
【题型】单选题
【结束】
6
【题目】特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如右图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2![]() C6+LiCoO2,下列说法不正确的是
C6+LiCoO2,下列说法不正确的是
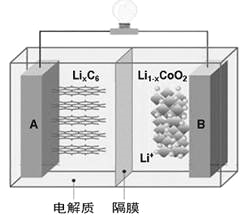
A. 据题意分析可知该隔膜只允许Li+通过,放电时Li+从左边移向右边
B. 放电时,正极锂的化合价未发生改变
C. 废旧钴酸锂电池进行“放电处理”让Li+进入石墨中而有利于回收
D. 充电时阳极的电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.下列说法不正确的是( )

A. 电流从右侧电极经过负载后流向左侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为:2NH3-6e-=N2+6H+
D. 当有4.48L NO2(标准状况) 被处理时,转移电子为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 含离子键的晶体不一定是离子晶体 B. 含共价键的晶体一定是分子晶体
C. 只含极性键的分子可能不是极性分子 D. 含非极性键的分子一定是非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:该反应的热化学方程式为
________________________________
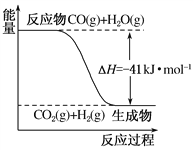
(2)已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131 kJ·mol-1,则C(s)+CO2(g)===2CO(g) ΔH=________。
(3)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391.55 kJ·mol-1。则1/2N2(g)+3/2H2(g)===NH3(g) ΔH=________。
Ⅱ.下图是一个化学过程的示意图,回答下列问题:
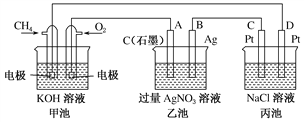
(1)甲池是________装置,乙装置中电极A的名称是____。
(2)甲装置中通入CH4的电极反应式为_______________________,乙装置中电极B(Ag)的电极反应式为_______________________
(3)一段时间,当丙池中产生112 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25 ℃时的pH=________。(已知:NaCl溶液足量,电解后溶液体积为500 mL)。若要使丙池恢复电解前的状态,应向丙池中通入________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.油脂、糖类和蛋白质都能发生水解反应
B.油脂皂化反应可用硫酸作催化剂
C.淀粉溶液中加入硫酸,加热4~5 min,再加入少量银氨溶液,加热,有光亮银镜生成
D.福尔马林能使蛋白质发生变性,可用于浸制动物标本
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com