
【题目】下列说法中正确的是( )
A. 含离子键的晶体不一定是离子晶体 B. 含共价键的晶体一定是分子晶体
C. 只含极性键的分子可能不是极性分子 D. 含非极性键的分子一定是非极性分子
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】铝箔在酒精灯上加热至熔化的实验现象与下列性质的叙述无关的是( )
A. 铝表面可形成一层氧化物保护膜
B. 铝的熔点较低
C. Al2O3熔点高,酒精灯不能将其熔化
D. 铝能与酸或强碱溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如右图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2![]() C6+LiCoO2,下列说法不正确的是
C6+LiCoO2,下列说法不正确的是
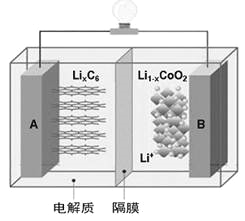
A. 据题意分析可知该隔膜只允许Li+通过,放电时Li+从左边移向右边
B. 放电时,正极锂的化合价未发生改变
C. 废旧钴酸锂电池进行“放电处理”让Li+进入石墨中而有利于回收
D. 充电时阳极的电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+
【答案】C
【解析】电解质是能传导Li+的高分子材料,所以隔膜只允许Li+通过,根据图示,A是负极,放电时Li+从左边移向右边,故A正确;放电时,正极Co元素化合价降低、锂的化合价未发生改变,故B正确;“放电处理”,Li+进入Li1-xCoO2中,故C错误;充电时阳极失电子发生氧化反应,电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+,故D正确。
点睛:原电池中负极失电子发生氧化反应,正极得电子发生还原反应;电解质溶液中阳离子移向正极、阴离子移向负极。
【题型】单选题
【结束】
7
【题目】下列溶液中各微粒的浓度关系正确的是
A. 0.2 mol·L-1的Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
B. pH相等的NaF与CH3COOK溶液:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)]
C. pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液,NH4+大小顺序为①=②>③
D. 0.2 mol·L-1HCl与0.1 mol·L-1NaAlO2溶液等体积混合:c(Cl-)>c(Na+)>c(H+)>c(Al3+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有盐酸和氯化钙的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如右图所示,则X是( )
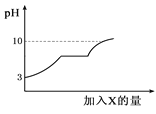
A. 浓硫酸 B. 澄清石灰水
C. 烧碱溶液 D. 纯碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将 2molSO2 和 1molO2 通入体积为 2L 的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ,△H=-196.6kJ/mol. 2min 时反应达到化学平衡,此时测得反应物O2 还剩余 0.8mol,请填写下列空白:
2SO3(g) ,△H=-196.6kJ/mol. 2min 时反应达到化学平衡,此时测得反应物O2 还剩余 0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成 SO3 的平均反应速率为__________ ;平衡时,SO2 转化率为_____________
(2)下列叙述能证明该反应已达到化学平衡状态的是 __________
A.容器内压强不再发生变化 B.SO2 的体积分数不再发生变化
C.容器内气体原子总数不再发生变化 D.相同时间内消耗 2nmolSO2 的同时消耗 nmolO2
E.相同时间内消耗 2nmolSO2 的同时生成 nmolO2 F.混合气体密度不再变化
(3)以下操作会引起化学反应速率变快的是__________
A.向容器中通入O2 B.扩大容器的体积 C.使用正催化剂
D.升高温度 E.向容器中通入氦气。
(4)t2℃时,若将物质的量之比 n(SO2) :n(O2)=1:1 的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了 20%。则SO2 的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种固体物质溶解度曲线如图所示。请回答:
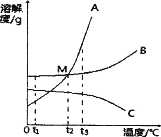
(1)图中M点表示_________________;
(2)t3℃时A、B、C三种物质的溶解度由小到大的顺序是____________;
(3)现有t1℃时A、B、C的三种饱和溶液,分别将它们升温到t3℃,溶质的质量分数由大到小的顺序是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。消除汽车尾气中的NO、CO,有利于减少PM2.5 的排放。已知如下信息:
①2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H1=- 748kJ/mol
2CO2(g)+N2(g) △H1=- 748kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-565kJ/mol
(1)在一定条件下N2和O2会转化为NO,写出该反应的热化学方程式:______________。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L 恒容密闭容器中加入0.2moINO 和0.3moICO,在催化剂存在的条件下发生反应①,10min 时反应达到平衡,测得10min 内v(NO)=7.5×10-3mol/(Lmin),则平衡后CO 的转化率为_______________。
(3)其他条件相同,t min 时不同温度下测得NO 的转化率如图( I)所示。A 点的反应速率v正___(填“>”、“<”或“=”)v逆,A、B两点反应的平衡常数较大的是_______(填“A”或“B”),理由是__________________。
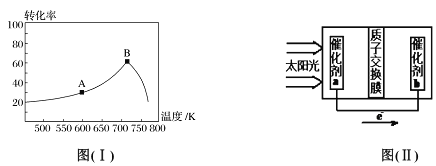
(4)已知常温下: Ka(HNO2)=7.1×10-4mol/L;Kb(NH3·H2O)=1.7×10-5mol/L。0.1mol/LNH4NO2溶液中离子浓度由大到小的顺序是_________,常温下NO2-水解反应的平衡常数K=____。
(5)人工光合作用能够借助太阳能用CO2和水制备化学原料,图(II )是通过人工光合作用制备HCOOH 的原理示意图,请写出催化剂b处的电极反应式:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com