
【题目】下列各种混合物中,能用分液漏斗进行分离的是( )
A.酒精和水B.水和四氯化碳C.碘和四氯化碳D.汽油和植物油
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的 SO2 气体和 SO3 气体相比较,下列叙述中正确的是
A. 物质的量之比为 4:5 B. 密度比为 4:5
C. 体积比为 1:1 D. 原子数之比为 3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化物、酸、碱、盐都属于化合物。甲、乙、丙、丁、M是初中化学常见的化合物,其中甲、乙、丙、丁分属上述四种不同类别的化合物,M与甲属于同种类别的化合物。它们之间的部分转化关系如图所示(部分反应物、生成物、反应条件已略去。“—”表示物质之间能发生反应,“→”表示物质之间的转化关系)。下列推论错误的是( )
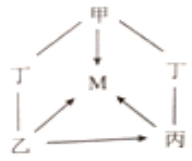
A. 若甲是碳酸钙,则可以用水鉴别乙和丙
B. 若乙可用于改良酸性土壤,则甲可以是氧化铜
C. 若丙是碳酸钠,则甲与丁溶液混合可以得到黄色溶液
D. 若丁是氢氧化钠,则甲可以通过中和反应转化为M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界中,回答下列问题:
(1) 碳在形成化合物时,其键型以共价键为主,原因是___________________________。
(2) (CN)2分子中,共价键的类型有________________,C原子的杂化轨道类型是____________
(3) CO能与金属Fe形成Fe(CO)5,该化合物熔点为253K,沸点为376K,其固体属于________晶体。
(4) 与碳同族的基态Ge原子的核外电子排布式为___________,有________个未成对电子。
(5) 石墨可用作锂离子电池的负极材料,充电时发生下述反应:Li1-xC6+xLi++xe→LiC6。其结果是:Li+嵌入石墨的A、B层间。现有某石墨嵌入化合物每个六元环都对应一个Li+,写出它的化学式:_______。

(6) 碳有多种同素异形体,其中金刚石的晶体晶胞如下图所示:
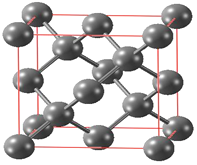
已知金刚石立方晶胞边长a pm,请计算晶体密度____________g/cm3(请用含a和NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应的实验装置如图。下列有关铝热反应的说法中,不正确的是
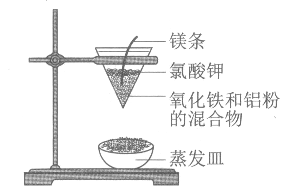
A. 铝热反应是放热反应
B. 铝热反应可用于冶炼某些高熔点金属
C. 实验中镁条的主要作用是还原氧化铁
D. 实验现象为火星四溅,漏斗下方有红热熔融物流出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组混合液:①乙酸乙酯和乙酸钠溶液;②乙醇和丁醇;③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中常伴随着能量变化。将Al条打磨后,插入6 mol/L盐酸中。
(1)Al与盐酸反应的离子方程式是________。
(2)该反应的能量变化可用下图中的________表示(填序号)。

(3)H2的产生速率随时间的变化如图所示。

t1~t2速率变化的主要原因是________。
t2~t3速率变化的主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属晶体判断正确的是
A.简单立方、配位数6、空间利用率68%
B.钾型、配位数6、空间利用率68%
C.镁型、配位数8、空间利用率74%
D.铜型、配位数12、空间利用率74%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 含离子键的晶体不一定是离子晶体 B. 含共价键的晶体一定是分子晶体
C. 只含极性键的分子可能不是极性分子 D. 含非极性键的分子一定是非极性分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com