
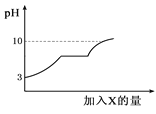
【题目】现有盐酸和氯化钙的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如右图所示,则X是( )
A. 浓硫酸 B. 澄清石灰水
C. 烧碱溶液 D. 纯碱溶液
【答案】D
【解析】
由于随着X的加入溶液由酸性逐渐的变为中性又变为碱性,因此X应是一种碱性物质,首先排除A,再就是图象的中间一段溶液的pH值没有发生变化,说明X也能与氯化钙发生反应,当把氯化钙也消耗完以后,再加X就会导致溶液变为碱性,据此分析解答。
A项,加入浓硫酸,溶液的酸性增强,pH减小,pH不可能大于7,故A项错误;
B项,澄清石灰水即氢氧化钙溶液,呈碱性;若加入澄清石灰水,氢氧化钙与盐酸反应pH增大,但与氯化钙不反应,所以图像应该是上升的曲线,没有一段直线,故B项错误;
C项,氢氧化钠与盐酸发生中和,pH增大,pH到7后说明盐酸已反应完,由于氢氧化钠与氯化钙不反应,继续加入氢氧化钠,溶液的pH继续增大,图像应该是上升的曲线,没有一段直线,故C项错误;
D项,加入纯碱(即碳酸钠)后,碳酸钠与盐酸发生反应,pH增大,pH到7后说明盐酸已反应完,碳酸钠与氯化钙反应生成氯化钠和碳酸钙沉淀,pH值不变,氯化钙反应完后碳酸钠过量,由于碳酸钠显碱性,pH增大,与图像一致,故D项正确;
正确选项D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】现有三组混合液:①乙酸乙酯和乙酸钠溶液;②乙醇和丁醇;③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质能与H2反应,反应情况如下表所示:
F2 | 在暗处能剧烈化合并发生爆炸,生成的氟化氢很稳定 |
Cl2 | 光照或点燃发生反应,生成的氯化氢较稳定 |
Br2 | 加热至一定温度才能反应,生成的溴化氢不如氯化氢稳定 |
I2 | 不断加热才能缓慢反应,同一条件下,生成的HI会分解 |
(1)卤族元素位于周期表中的_________族。
(2)用电子式表示HCl的形成过程________。
(3)依据上表,可以推测出:随着核电荷数的增加,________(填字母)。
a. 单质的熔沸点逐渐升高 b. 元素的非金属性逐渐减弱
c. 卤化氢的还原性依次减弱 d. 卤化氢的稳定性依次减弱
(4)I2与H2反应的化学方程式是________。
(5)不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近。BrCl和FeCl2水溶液发生反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.下列说法不正确的是( )

A. 电流从右侧电极经过负载后流向左侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为:2NH3-6e-=N2+6H+
D. 当有4.48L NO2(标准状况) 被处理时,转移电子为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 含离子键的晶体不一定是离子晶体 B. 含共价键的晶体一定是分子晶体
C. 只含极性键的分子可能不是极性分子 D. 含非极性键的分子一定是非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.蒸发是为了除去溶剂得到晶体,蒸馏是为了得到液体成分
B.金属氧化物一定是碱性氧化物
C.酸性氧化物一定是非金属氧化物
D.物质的量是七个基本物理量之一,是用于描述一定粒子数目的物理量
查看答案和解析>>
科目:高中化学 来源: 题型:
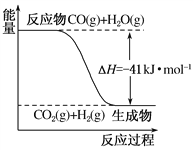
【题目】Ⅰ.研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:该反应的热化学方程式为
________________________________
(2)已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131 kJ·mol-1,则C(s)+CO2(g)===2CO(g) ΔH=________。
(3)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391.55 kJ·mol-1。则1/2N2(g)+3/2H2(g)===NH3(g) ΔH=________。
Ⅱ.下图是一个化学过程的示意图,回答下列问题:
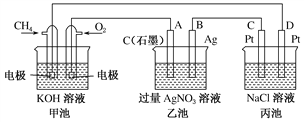
(1)甲池是________装置,乙装置中电极A的名称是____。
(2)甲装置中通入CH4的电极反应式为_______________________,乙装置中电极B(Ag)的电极反应式为_______________________
(3)一段时间,当丙池中产生112 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25 ℃时的pH=________。(已知:NaCl溶液足量,电解后溶液体积为500 mL)。若要使丙池恢复电解前的状态,应向丙池中通入________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①标准状况下,0.2 mol任何物质的体积均为4.48 L
②若1 mol气体的体积为22.4 L,则它一定处于标准状况下
③标准状况下,1 LCO和1 L H2O的物质的量相同
④标准状况下,1 g H2和14 g N2的体积相同
⑤28 g CO的体积为22.4 L
⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑦在同温同体积时,气体物质的物质的量越大,则压强越大
⑧同温同压下,气体的密度与气体的相对分子质量成正比
A. ①②③④ B. ②③⑥⑦⑧ C. ④⑦⑧ D. ⑤⑥⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com