
【题目】纳米级Fe3O4呈黑色,因其有磁性且粒度小而在磁记录材料、生物功能材料等诸多领域有重要应用,探究其制备和用途意义重大。
(1)还原-沉淀法:①用还原剂Na2SO3将一定量Fe3+可溶盐溶液中的![]() Fe3+还原,使Fe2+和Fe3+的物质的量比为1 : 2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:__________。
Fe3+还原,使Fe2+和Fe3+的物质的量比为1 : 2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:__________。
(2)电化学法也可制备纳米级Fe3O4,用面积为4 cm2的不锈钢小球(不含镍、铬)为工作电极,铂丝作阴极,用Na2SO4溶液作为电解液,电解液的pH维持在10左右,电流50 mA。生成Fe3O4的电极反应为______。
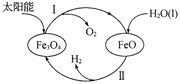
(3)已知:H2O(1) === H2(g)+![]() O2(g) △H =+285.5 kJ·mol-l,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。过程I:__________。过程Ⅱ:3FeO(s)+H2O(l) === H2(g)+Fe3O4(s) △H =+128.9 kJ·mol-1
O2(g) △H =+285.5 kJ·mol-l,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。过程I:__________。过程Ⅱ:3FeO(s)+H2O(l) === H2(g)+Fe3O4(s) △H =+128.9 kJ·mol-1
(4)磁铁矿(Fe3O4)常作冶铁的原料,主要反应为Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2 (g),该反应的△H < 0,T℃时,在1 L恒容密闭容器中,加入Fe3O4、CO各0.5 mol,10 min后反应达到平衡时,容器中CO2的浓度是0.4 mol·L-1。
3Fe(s)+4CO2 (g),该反应的△H < 0,T℃时,在1 L恒容密闭容器中,加入Fe3O4、CO各0.5 mol,10 min后反应达到平衡时,容器中CO2的浓度是0.4 mol·L-1。
①T℃时,10 min内用Fe3O4表示的平均反应速率为___g·min-1。
②T℃时,该反应的平衡常数为____________。
【答案】Fe2++2Fe3++8NH3·H2O === Fe3O4↓+8![]() +4H2O 3Fe-8e-+8OH-=== Fe3O4↓+2H2O 2Fe3O4(s) === 6FeO(s)+O2(g) △H =+313.2 kJ·mol-l 2.32 256
+4H2O 3Fe-8e-+8OH-=== Fe3O4↓+2H2O 2Fe3O4(s) === 6FeO(s)+O2(g) △H =+313.2 kJ·mol-l 2.32 256
【解析】
![]() 可以表示为
可以表示为![]() ,即
,即![]() 中铁的价态为既有+2价也有+3价,+2价和+3价的铁原子之比为1:2。
中铁的价态为既有+2价也有+3价,+2价和+3价的铁原子之比为1:2。
(1)![]() 和
和![]() 的物质的量比为1 : 2,加入氨水制得
的物质的量比为1 : 2,加入氨水制得![]() ,一水合氨是弱碱,离子方程式为:
,一水合氨是弱碱,离子方程式为:![]() ,
,
答案为:![]() ;
;
(2)不锈钢小球(铁)为阳极,失电子生成![]() ,且溶液为碱性环境,故电极方程式为:
,且溶液为碱性环境,故电极方程式为:![]() ,
,
答案为:![]() ;
;
(3)过程I为![]() 分解生成
分解生成![]() 和氧气,故化学方程式为:
和氧气,故化学方程式为: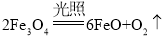 ,根据图像可以推知,整个过程为水分解生成氢气和氧气,即反应I和反应Ⅱ叠加得到总反应:
,根据图像可以推知,整个过程为水分解生成氢气和氧气,即反应I和反应Ⅱ叠加得到总反应:![]() △H1 =+285.5 kJ·mol-l,设反应Ⅱ焓变为△H2,则反应I的焓变为:
△H1 =+285.5 kJ·mol-l,设反应Ⅱ焓变为△H2,则反应I的焓变为:![]() ,故反应I的热化学方程式为:
,故反应I的热化学方程式为:![]() ,
,
故答案为:![]()
(4)①根据方程式![]() ,10 min后
,10 min后![]() 的浓度是0.4 mol·L-1,体积为1L,故
的浓度是0.4 mol·L-1,体积为1L,故![]() 的物质的量增加0.4mol,根据方程式
的物质的量增加0.4mol,根据方程式![]() 减少0.1mol(23.2g),故用Fe3O4表示的平均反应速率为
减少0.1mol(23.2g),故用Fe3O4表示的平均反应速率为![]() ,
,
故答案为:2.32 ;
②列三段式,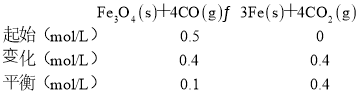 ,故平衡常数
,故平衡常数![]() ,
,
故答案为256。


科目:高中化学 来源: 题型:
【题目】I.根据表格信息,请回答下列问题:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
(1)反应①是________(填“吸热”或“放热”)反应。
(2)写出反应③的平衡常数K3的表达式_______________________。
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有____(填写字母序号)。
A.缩小反应容器的容积B.扩大反应容器的容积
C.升高温度D.使用合适的催化剂
E.设法减小平衡体系中的CO浓度
(5)若反应③的逆反应速率与时间的关系如图所示:
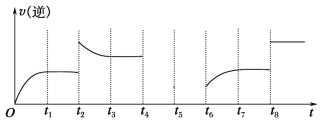
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时________;t8时________。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线。__________
Ⅱ.25℃,1.01×105Pa时,16g液态甲醇(CH3OH)完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奈必洛尔是一种用于血管扩张的降血压药物,

已知:乙酸酐的结构简式为![]() 。
。
请回答下列问题:
(1)B的分子式为______________,反应①的反应类型为________________
(2)C所含官能团的名称为__________________________________________。
(3)反应⑤的化学方程式为_________________,该反应的反应类型是_________________。
(4)写出满足下列条件的E的同分异构体的结构简式:___________、______________。
Ⅰ.苯环上只有三个取代基
Ⅱ.核磁共振氢谱图中只有4组吸收峰
Ⅲ.1mol该物质与足量NaHCO3溶液反应生成2molCO2
(5)根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备 的合成路线流程图(无机试剂任选)_____________。(合成路线流程图示例如下:CH3CH2Br
的合成路线流程图(无机试剂任选)_____________。(合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OHCH3COOCH2CH3)
CH3CH2OHCH3COOCH2CH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定微粒的数目相等的是
A.等物质的量的12CO2与14CO2含有的中子数
B.同温、同压、同体积的CO2和N2O含有的质子数
C.等质量的己烷和丁烷中含有的共用电子对数
D.等物质的量的钠和铁分别与足量氯气完全反应时转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在研究金矿床物质组分的过程中,通过分析发现了![]() 多金属互化物.
多金属互化物.
![]() 某金属互化物属于晶体,区别晶体和非晶体可通过 ______ 方法鉴别.该金属互化物原子在三维空间里呈周期性有序排列,即晶体具有 ______ 性.
某金属互化物属于晶体,区别晶体和非晶体可通过 ______ 方法鉴别.该金属互化物原子在三维空间里呈周期性有序排列,即晶体具有 ______ 性.
![]() 基态
基态![]() 的核外电子排布式 ______ ;配合物
的核外电子排布式 ______ ;配合物![]() 常温下为液态,易溶于
常温下为液态,易溶于![]() 、苯等有机溶剂.固态
、苯等有机溶剂.固态![]() 属于 ______ 晶体.
属于 ______ 晶体.
![]() 铜能与类卤素
铜能与类卤素![]() 反应生成
反应生成![]() 分子中含有
分子中含有![]() 键的数目为 ______ ;
键的数目为 ______ ;
类卤素![]() 对应的酸有两种,理论上硫氰酸
对应的酸有两种,理论上硫氰酸![]() 的沸点低于异硫氰酸
的沸点低于异硫氰酸![]() 的沸点,其原因是 ______ ;
的沸点,其原因是 ______ ;
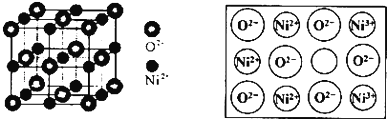
![]() 立方
立方![]() 氧化镍
氧化镍![]() 晶体的结构如图所示,其晶胞边长为apm,列式表示NiO晶体的密度为 ______
晶体的结构如图所示,其晶胞边长为apm,列式表示NiO晶体的密度为 ______ ![]() 不必计算出结果,阿伏加德罗常数的值为
不必计算出结果,阿伏加德罗常数的值为![]() 人工制备的NiO晶体中常存在缺陷
人工制备的NiO晶体中常存在缺陷![]() 如图 一个
如图 一个![]() 空缺,另有两个
空缺,另有两个![]() 被两个
被两个![]() 所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化.已知某氧化镍样品组成
所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化.已知某氧化镍样品组成![]() ,该晶体中
,该晶体中![]() 与
与![]() 的离子个数之比为 ______ .
的离子个数之比为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】坦桑石是一种世界公认的新兴宝石,这种宝石于1967年首次在赤道雪山脚下的阿鲁沙地区被发现。坦桑石的主要化学成分为![]() ,还可含有V、Cr、Mn等元素。
,还可含有V、Cr、Mn等元素。
![]() 下列状态的铝中,电离最外层的一个电子所需能量最大的是________
下列状态的铝中,电离最外层的一个电子所需能量最大的是________![]() 填序号
填序号![]() 。
。
①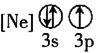 ②
②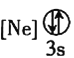 ③
③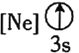 ④
④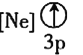
![]() 烟酸铬是铬的一种化合物,其合成过程如下:
烟酸铬是铬的一种化合物,其合成过程如下:
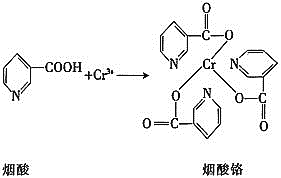
![]() 核外电子排布式为________。
核外电子排布式为________。
![]() 、C、N、O的电负性由大到小的顺序是_________。
、C、N、O的电负性由大到小的顺序是_________。
![]() 烟酸中碳、氮原子的杂化方式分别为________、________。
烟酸中碳、氮原子的杂化方式分别为________、________。
![]() 分子中的大
分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数
键的电子数![]() 如二氧化碳分子中的大
如二氧化碳分子中的大![]() 键可表示为
键可表示为![]() ,则烟酸中的大
,则烟酸中的大![]() 键应表示为___________。
键应表示为___________。
![]() 、
、![]() 都极易水解。
都极易水解。![]() 、
、![]() 都属于______
都属于______![]() 填“极性”或“非极性”
填“极性”或“非极性”![]() 分子,其熔点的关系为
分子,其熔点的关系为![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 将Mn掺入GaAs晶体
将Mn掺入GaAs晶体![]() 图甲
图甲![]() 可得到稀磁性半导体材料
可得到稀磁性半导体材料![]() 图乙
图乙![]() ,图甲、图乙晶体结构不变。
,图甲、图乙晶体结构不变。
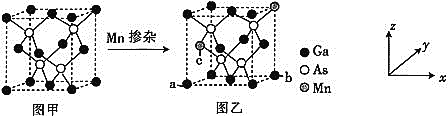
![]() 图乙中a点和b点的原子坐标参数分别为
图乙中a点和b点的原子坐标参数分别为![]() 0,
0,![]() 和
和![]() 1,
1,![]() ,则c点的原子坐标参数为________。
,则c点的原子坐标参数为________。
![]() 设图甲晶体的密度为
设图甲晶体的密度为![]() ,用
,用![]() 表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个镓原子之间的距离为________________pm。
表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个镓原子之间的距离为________________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池的发展已经进入了第三代。第三代就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜硅系太阳能电池。完成下列填空:
(1)亚铜离子(Cu+)基态时的电子排布式为____________;
(2)硒为第四周期元素,相邻的元素有砷和溴,则这3种元素的第一电离能I1从大到小顺序为(用元素符号表示)_______________________________;用原子结构观点加以解释_________________________。
(3)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具 有孤对电子的分子或离子生成加合物,如BF3能与NH3反应生成BF3NH3 。BF3NH3中B原子的杂化轨道类型为__________,N原子的杂化轨道类型为 ______________ ,B与 N之间形成 __________________ 键。
(4)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得如图所示的金刚砂(SiC)结构;金刚砂晶体属于____________(填晶体类型)在SiC结构中,每个C原子周围最近的C原子数目为 ______________。
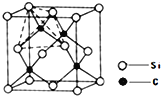
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B. ![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C. 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D. 水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.无色溶液中:Al3+、NH4+、Cl-、S2-
B.使酚酞显红色的溶液中:Na+、ClO-、CO32-、NO3-
C.0.1mol·L-1FeCl3溶液中:Mg2+、NH4+、SCN-、SO42-
D.由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Fe2+、Cu2+、SO42-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com