
【题目】下列实验操作都能够达到预期目的是
A.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸,并测得某溶液pH为![]()
B.中和pH与体积均相同的NaOH溶液和氨水,结果消耗![]() 的物质的量一样多
的物质的量一样多
C.酸碱中和滴定的终点是指酸和碱恰好完全反应,此时溶液一定呈中性
D.在HCl气氛中蒸干![]() 溶液能到得纯净的无水氯化铝
溶液能到得纯净的无水氯化铝
【答案】D
【解析】
A.水湿润pH试纸,稀释了待测溶液,使溶液的酸碱性减弱,若测定的是酸性溶液,则会使测定结果变大;若测定的是碱性溶液,则会使测定结果变小;若测定的是中性溶液,则会使测定结果不变,且测得值只能是整数,故A错误;
B.一水合氨是弱电解质,NaOH是强电解质,相同温度下pH相等的氢氧化钠和氨水溶液,氨水浓度大于NaOH,根据![]() 知,两种溶液中溶质的物质的量不等,所以消耗硫酸的物质的量不等,故B错误;
知,两种溶液中溶质的物质的量不等,所以消耗硫酸的物质的量不等,故B错误;
C.酸和碱恰好完全反应,若是强酸强碱反应,溶液呈中性,若是强酸弱碱反应,溶液呈酸性,若是弱酸强碱反应溶液呈碱性,故C错误;
D.![]() 加热水解生成
加热水解生成![]() ,在HCl气氛中蒸干
,在HCl气氛中蒸干![]() 溶液抑制铝离子水解,能到得纯净的无水氯化铝,故D正确.
溶液抑制铝离子水解,能到得纯净的无水氯化铝,故D正确.
故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列物质与其用途完全符合的有多少条( )
![]() 光导纤维
光导纤维 ![]() 制玻璃
制玻璃 ![]() 红色油漆或涂料
红色油漆或涂料 ![]() 耐火材料
耐火材料 ![]() 消毒剂
消毒剂 ![]() 制纯碱
制纯碱![]() 食品漂白剂
食品漂白剂![]() 焊接钢轨
焊接钢轨![]() 制冷剂.
制冷剂.![]() 人工降雨
人工降雨
A.6B.7C.5D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A.甲酸钠溶液和盐酸反应:HCOO-+H+=HCOOH
B.硫化钠的第一步水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
C.醋酸钡溶液和硫酸反应:Ba2++SO42—=BaSO4↓
D.氢氧化钙溶液和碳酸氢镁反应:Ca2++OH-+HCO3-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应2HI(g)![]() H2(g)+ I2(g)(正反应吸热)达到平衡时,要使混合气体的颜色加深,可采取的措施是: ①增大氢气的浓度 ②升高温度 ③降低温度 ④缩小体积 ⑤增大HI的浓度 ⑥减小压强
H2(g)+ I2(g)(正反应吸热)达到平衡时,要使混合气体的颜色加深,可采取的措施是: ①增大氢气的浓度 ②升高温度 ③降低温度 ④缩小体积 ⑤增大HI的浓度 ⑥减小压强
A. ①③⑥ B. ③⑤⑥ C. ①③⑤ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有可逆反应Fe(s)+CO2(g) ![]() FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)能判断该反应达到平衡状态的依据是_____(双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了
C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式_______。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=____(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。
①升高温度__________;②再通入CO___________。
(5)一氧化碳在工业上用途广泛,比如可以用来制备甲醇。甲醇是一种优质的液体燃料。利用甲醇,氧气,氢氧化钾溶液可以构成燃料电池。试写出该燃料电池的正极反应_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一固定体积的密闭容器中,能说明可逆反应A(s)+3B(g)![]() 2C(g)达到平衡状态的是( )
2C(g)达到平衡状态的是( )
①C的生成速率与C的分解速率相等
②单位时间内生成a mol A,同时生成3a mol B
③气体密度不再变化
④混合气体的总压强不再变化
⑤A、B、C的物质的量之比为1:3:2
⑥混合气体的总物质的量不再改变
A.②④⑤⑥B.①③④⑥C.①②④⑥D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.测定溶液的pH时,应先将pH试纸润湿,然后进行检测
B.为绘制中和滴定曲线,在滴定过程中,每隔相同时间用pH计测定一次混合溶液的pH
C.常温下若强酸强碱等体积中和后![]() ,则中和之前
,则中和之前![]()
D.在![]() 的某溶液中,水电离出的
的某溶液中,水电离出的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统的生物脱氮主要包括有氧条件下的硝化反应过程和缺氧环境下的反硝化反应过程,其工艺如下图所示。硝化过程中,![]() 先后被氧化为
先后被氧化为![]() 和
和![]() 。
。![]() 硝化过程中会使溶液酸度提高,需要加入NaHCO3进行中和;反硝化反应过程中,加入碳源(甲醇等有机物)将硝化反应中生成的
硝化过程中会使溶液酸度提高,需要加入NaHCO3进行中和;反硝化反应过程中,加入碳源(甲醇等有机物)将硝化反应中生成的![]() 和
和![]() 还原为N2,如:5CH3OH +6
还原为N2,如:5CH3OH +6![]() = 3N2↑+5CO2+7H2O+6OH-
= 3N2↑+5CO2+7H2O+6OH-
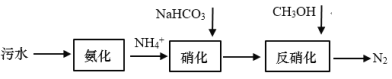
(1)请写出![]() 硝化生成
硝化生成![]() 的离子方程式:________。
的离子方程式:________。
(2)若1mol![]() 继续被氧化为
继续被氧化为![]() ,需消耗O2____L。(标准状况)
,需消耗O2____L。(标准状况)
(3)现在很多国家采用半硝化工艺(ANAMMOX) ,工作原理如下图所示:
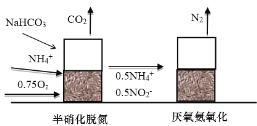
①写出厌氧氨氧化时![]() 与
与![]() 发生反应的离子方程式______。
发生反应的离子方程式______。
②若采用该方法,请判断是否需要加入碳源(甲醇),并简述理由______。
(4)研究发现,脱氮工艺常会产生一种温室气体N2O,目前普遍认为形成于硝化阶段,则生成N2O的可能原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下物质的转化关系图,回答有关问题:
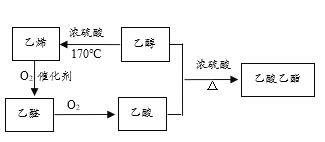
(1)上述物质中,_________(填结构简式,下同)的产量是衡量一个国家石油化工发展水平的标志;常见的酸性调味品中含有3%~5%的_________;具有香味的油状液体是_____________。
(2)乙醇中![]() 官能团名称是______,比乙醇少一个碳原子的同系物的结构简式是______。
官能团名称是______,比乙醇少一个碳原子的同系物的结构简式是______。
(3)生成乙酸乙酯的化学方程式是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com