
分析 (1)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答;
(2)根据热化学方程式和盖斯定律计算得到,反应焓变为负值反应为放热反应,焓变为正值则反应为吸热反应.
解答 解:(1)16g即1molCH4在氧气中燃烧生成CO2和液态水,放出889kJ热量,则热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31KJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31KJ/mol;
(2)①C(s)+O2(g)═CO2(g)△H1=-437.3kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H3=-285.8kJ•mol-1
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
依据盖斯定律①-②-③,得到:C(s)+H2O(g)═CO(g)+H2(g) n△H=+131.5kJ•mol-1,反应为吸热反应,此法是煤的气化,相比于传统的直接将煤中提取的C燃烧可以减少污染气体的排放,增大燃烧效率,便于运输和储存,
故答案为:+131.5;吸热;固体煤经处理变成气体燃料后,不仅可以大大减少SO2和烟尘对空气造成的污染,而且燃烧效率高,也便于运输.
点评 本题考查热化学方程式书写、盖斯定律的计算应用,掌握基础是解题关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 3:2:1 | B. | 1:2:3 | C. | 3:1:1 | D. | 1:3:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③ | B. | 只有①②④ | C. | 只有①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨工业中,将NH3及时液化分离有利于提高产率 | |
| B. | 工业上通常使用电解法制备金属钠、镁、铝、铁等 | |
| C. | 硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高 | |
| D. | 电解精炼铜时,将粗铜与电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2使品红、酸性高锰酸钾溶液褪色,分别体现了它的漂白性和还原性 | |
| B. | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变红,说明Fe(NO3)2样品已经变质 | |
| C. | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加盐酸沉淀不溶解,说明该溶液一定存在SO42- | |
| D. | 浓硫酸可用于干燥H2、NO2等气体,但不能干燥NH3、SO2等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO-被还原 | |
| B. | 消耗1mol还原剂,转移3mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 反应后溶液的酸性明显增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
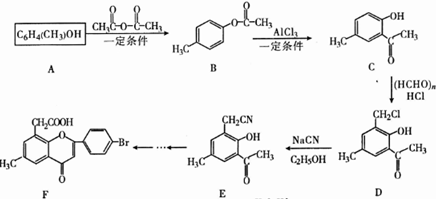
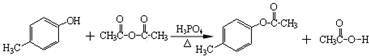
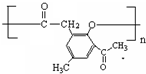 .
.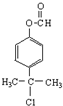 、
、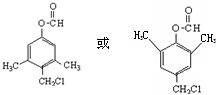 .
.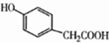 )的路线
)的路线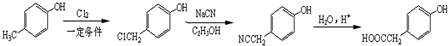 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; +Br2→
+Br2→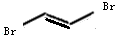 .
.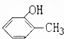 的两种物质,写出它们的名称:2-丙醇、邻甲基苯酚.
的两种物质,写出它们的名称:2-丙醇、邻甲基苯酚.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com