
【题目】我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他电池,电池总反应为V2O5 + xLi![]() LixV2O5。下列说法合理的是( )
LixV2O5。下列说法合理的是( )
A. 电池在放电时,Li+向负极移动
B. 锂在放电时作正极,充电时作阳极
C. 该电池充电时阳极的反应为LixV2O5 - xe- =V2O5 + xLi+
D. V2O5只是锂发生反应的载体,不参与电池反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关除杂的实验操作合理的是
A. 用加入过量氨水并过滤的方法除去NaCl溶液中混有的AlCl3
B. 除去NaCl溶液中少量的Na2S:加入AgCl后再过滤
C. 向MgCl2溶液中加入CaCO3粉末,充分搅拌后过滤可除去杂质FeCl3
D. 除去FeCl3溶液中少量的CuCl2:加入足量铁粉,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.已知C2H6的燃烧热为1090 kJ·mol-1,则表示C2H6燃烧热的热化学方程式为:
C2H6(g)+![]() O2(g) = 2CO2(g)+3H2O(g) ΔH=-1090 kJ·mol-1
O2(g) = 2CO2(g)+3H2O(g) ΔH=-1090 kJ·mol-1
B.已知2CO(g)+O2(g) = 2CO2(g) ΔH=-566 kJ·mol-1,则CO的燃烧热ΔH=-283 kJ
C.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度
D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1,说明稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时放出57.3 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ·mol﹣1,甲醚可作燃料电池的燃料.
(1)写出甲醚燃烧的热化学方程式 ;已知H2(g)和C(s)的燃烧热分别是285.8kJ·mol﹣1、393.5kJ·mol﹣1;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热△H= kJ·mol﹣1;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)![]() CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是 (选填编号,注意大小写)。
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将 (填“变大”、“变小”或“不变”,下同)。
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式的其中一个产物是CO32﹣,请写出该反应的负极反应式 ;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL NaCl溶液,装置如图所示,请写出电解过程中Y电极附近观察到的现象是 ;当燃料电池消耗2.8LO2(标准状况下)时,计算此时:NaCl溶液中C(OH-)= mol/L(假设溶液的体积不变,气体全部从溶液中逸出).
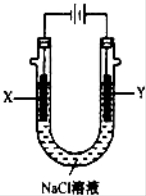
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类的生活、生产密切相关,下列说法不正确的是
A. 烹鱼时加入少量的料酒和食醋可减少腥味,增加香味
B. 镁着火可以用二氧化碳灭火器灭火
C. 常温下可用铝制容器盛装浓硫酸
D. 雾是一种常见的胶体,能发生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷中混有乙烯,欲除乙烯得到纯净的甲烷,可依次将其通过下列哪组试的洗气瓶( )
A.澄清石灰水,浓H2SO4
B.溴水,浓H2SO4
C.酸性高锰酸钾溶液,浓H2SO4
D.浓H2SO4 , 酸性高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1 NH3·H2O溶液中存在如下电离平衡:NH3·H2O![]() NH4+ + OH- 。对于该平衡,下列叙述中正确的是
NH4+ + OH- 。对于该平衡,下列叙述中正确的是
A.加入水时,溶液中c(OH-) / c(NH3·H2O) 增大
B.加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小
C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(OH-)增大
D.降低温度,溶液中c(NH4+)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com