
【题目】![]() 是一种重要的化工原料,被广泛应用在工农业生产中。请运用所学知识解决下列问题:
是一种重要的化工原料,被广泛应用在工农业生产中。请运用所学知识解决下列问题:
已知反应:![]()
![]()
![]()
![]() 工业制取炭黑的方法之一是将甲烷隔绝空气加热到
工业制取炭黑的方法之一是将甲烷隔绝空气加热到![]() 进行裂解。该反应的热化学方程式为______。
进行裂解。该反应的热化学方程式为______。
![]() 容积固定为1L的密闭容器内充入
容积固定为1L的密闭容器内充入![]() 和
和![]() ,保持
,保持![]() 发生反应
发生反应![]() ,用压力计监测反应过程中容器内压强的变化如下表:
,用压力计监测反应过程中容器内压强的变化如下表:
反应时间 | 0 | 5 | 10 | 15 | 20 | 25 |
压强 |
|
|
|
|
|
|
则反应从开始到20min时,以CO浓度变化表示的平均反应速率![]() ______。
______。
![]() 对于反应
对于反应![]() 来说:
来说:
![]() 时,平衡常数
时,平衡常数![]() 。
。![]() 测得密闭容器中各物质达到平衡时物质的量浓度分别为:
测得密闭容器中各物质达到平衡时物质的量浓度分别为:![]() ,
,![]() ,
,![]() ,
,![]() ,则
,则![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ,判断依据是______。
,判断依据是______。
![]() 下列措施有利于提高反应混合气中
下列措施有利于提高反应混合气中![]() 含量的是______。
含量的是______。
A.使用催化剂 ![]() 升高温度
升高温度 ![]() 及时导出CO
及时导出CO![]() 增大反应体系的压强
增大反应体系的压强
![]() 一定条件下,将
一定条件下,将![]() 与
与![]() 按物质的量之比1:1置于恒容密闭容器中反应,下列能说明该反应达到平衡状态的是______。
按物质的量之比1:1置于恒容密闭容器中反应,下列能说明该反应达到平衡状态的是______。
A.![]()
![]()
B.体系中混合气体密度不变
C.![]() 与
与![]() 的转化率相等
的转化率相等
D.![]() 与
与![]() 物质的量之比不再改变
物质的量之比不再改变
E.反应体系压强不再改变
![]() 以甲烷为燃料的新型电池得到广泛应用。下图是甲烷燃料电池工作原理的示意图。
以甲烷为燃料的新型电池得到广泛应用。下图是甲烷燃料电池工作原理的示意图。
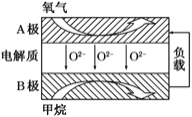
![]() 极上的电极反应式为______。
极上的电极反应式为______。
![]() 以该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到
以该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到![]() 标准状况
标准状况![]() 气体时,消耗甲烷的体积为______
气体时,消耗甲烷的体积为______![]() 标准状况
标准状况![]() 。
。
【答案】![]()
![]()
![]() 反应
反应![]() 属于吸热反应,升高温度K值增大,
属于吸热反应,升高温度K值增大,![]() 的
的![]() ,所以
,所以![]()
![]()
![]()
![]()
![]()
【解析】
![]() ;根据盖斯定律用
;根据盖斯定律用![]() 得:
得:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 从反应开始到20min时,设CO的浓度变化量是x,
从反应开始到20min时,设CO的浓度变化量是x,
![]()
初始浓度:2 4 0
变化浓度:x 2x x
平衡浓度:![]()
![]() x
x
根据反应前后压强之比等于物质的量之比,则![]() ,解得:
,解得:![]() ;从反应开始到20min时,以CO表示的平均反应速率
;从反应开始到20min时,以CO表示的平均反应速率![]() ,故答案为:
,故答案为:![]() ;
;
![]() 对于反应
对于反应![]() ,
,![]() 测得密闭容器中各物质达到平衡时物质的量浓度分别为:
测得密闭容器中各物质达到平衡时物质的量浓度分别为:![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() 时的平衡常数
时的平衡常数![]() ,该反应为吸热反应,升高温度平衡向着正向移动,平衡常数增大,则温度
,该反应为吸热反应,升高温度平衡向着正向移动,平衡常数增大,则温度![]() ,故答案为:
,故答案为:![]() ;反应
;反应![]() 属于吸热反应,升高温度K值增大,
属于吸热反应,升高温度K值增大,![]() 的
的![]() ,所以
,所以![]() ;
;
![]() 使用催化剂,化学平衡不移动,无法提高反应混合气中
使用催化剂,化学平衡不移动,无法提高反应混合气中![]() 含量,故A错误;
含量,故A错误;
B.该反应为吸热反应,升高温度,平衡向着正向移动,可提高反应混合气中![]() 含量,故B正确;
含量,故B正确;
C.及时导出CO,生成物浓度减小,平衡向着正向移动,能够提高反应混合气中![]() 含量,故C正确;
含量,故C正确;
D.增大反应体系的压强,平衡向着逆向移动,反应混合气中![]() 含量减小,故D错误;
含量减小,故D错误;
故答案为:BC;
![]() 一定条件下,将
一定条件下,将![]() 与
与![]() 按物质的量之比1:1置于恒容密闭容器中发生反应
按物质的量之比1:1置于恒容密闭容器中发生反应![]() 。
。
A.![]()
![]() ,表明正逆反应速率相等,该反应达到平衡状态,故A正确;
,表明正逆反应速率相等,该反应达到平衡状态,故A正确;
B.体系中混合气体密度始终不变,不能根据混合气体密度判断平衡状态,故B错误;
C.![]() 与
与![]() 按物质的量之比1:1置于恒容密闭容器中发生反应,二者的计量数相等,则
按物质的量之比1:1置于恒容密闭容器中发生反应,二者的计量数相等,则![]() 与
与![]() 的转化率始终相等,无法判断平衡状态,故C错误;
的转化率始终相等,无法判断平衡状态,故C错误;
D.![]() 与
与![]() 的初始物质的量相等,反应按照1:1进行,则二者的物质的量之比始终不变,无法判断平衡状态,故D错误;
的初始物质的量相等,反应按照1:1进行,则二者的物质的量之比始终不变,无法判断平衡状态,故D错误;
E.该反应为气体体积增大的反应,压强为变量,当反应体系压强不再改变时,表明正逆反应速率相等,该反应达到平衡状态,故E正确;故答案为:AE;
![]() 燃料电池中燃料在负极发生氧化反应,甲烷失电子在熔融盐中生成二氧化碳气体,则B极上的电极反应式为:
燃料电池中燃料在负极发生氧化反应,甲烷失电子在熔融盐中生成二氧化碳气体,则B极上的电极反应式为:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 若用该燃料电池作电源,用石墨作电极电解硫酸铜溶液,阳极收集到的
若用该燃料电池作电源,用石墨作电极电解硫酸铜溶液,阳极收集到的![]() 标准状况
标准状况![]() 气体为氧气,物质的量为:
气体为氧气,物质的量为:![]() ,电极反应为:
,电极反应为:![]() ,结合电子守恒和电极反应可得:
,结合电子守恒和电极反应可得:![]() ,
,![]() ,则消耗甲烷物质的量为:
,则消耗甲烷物质的量为:![]() ,标准状况下的体积为:
,标准状况下的体积为:![]() ,故答案为:56。
,故答案为:56。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用O2将HCl转化为Cl2,可提高效益,减少污染,
(1)传统上该转化通过如图所示的催化剂循环实现,

其中,反应①为:2HCl(g) + CuO(s)![]() H2O(g)+CuCl2(g) △H1
H2O(g)+CuCl2(g) △H1
反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为___________(反应热用△H1和△H2表示)。
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性,
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的aHCl—T曲线如图,则总反应的△H___0(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是_______。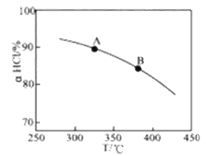
②在上述实验中若压缩体积使压强增大,画出相应aHCl—T曲线的示意图,并简要说明理由______________。
③下列措施中有利于提高aHCl的有___________。
A、增大n(HCl) B、增大n(O2)
C、使用更好的催化剂 D、移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率______(以mol·min-1为单位,写出计算过程)。
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知FeCl3溶液与KI溶液的反应为可逆反应,某小组同学对该反应进行实验探究。
(1)甲同学首先进行了实验1。
实验 1 | 实验步骤 | 实验现象 |
ⅰ. 取2 mL 1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴(1滴约为0.05 mL,下同)。 | ⅰ. 溶液呈棕黄色。 | |
ⅱ. 向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ. 溶液不显红色。 |
① 写出FeCl3溶液与KI溶液反应的离子方程式_______________________。
② 加入KSCN溶液的目的是_______________________________________。
③ 甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,改进实验方案,进行实验2。
实验2 | 实验步骤 | 实验现象 |
ⅰ. 取2 mL 0.1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴。 | ⅰ. 溶液呈棕黄色。 | |
ⅱ. 向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ. 溶液显红色。 | |
ⅲ. 继续加入2 mL CCl4,充分振荡、静置。 | ⅲ. 液体分层,上层红色消失,变为棕黄色,下层呈紫红色。 |
本实验改用0.1 mol·L-1 KI溶液的目的是_________________________________________。
用化学平衡原理解释实验2中加入CCl4后上层溶液红色消失的原因________________。
(2)甲同学认为“用CCl4萃取后上层溶液仍为棕黄色”的原因是I2未被充分萃取,但乙同学查阅资料得到信息:I2、I3-在水中均呈棕黄色,两者有如下关系:I2+I-![]() I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
① 为验证假设,乙同学设计并完成了实验3。
实验3 | 实验步骤 | 实验现象 |
ⅰ. 取1 mL实验2中棕黄色的上层清液,再加入2 mL CCl4, 振荡、静置。 | ⅰ. 液体分层,上层呈黄色,下层呈紫红色。 | |
ⅱ. 取1 mL饱和碘水,加入2 mL CCl4, 振荡、静置。 | ⅱ. 液体分层,上层为无色,下层呈紫红色。 |
实验3的结论是_________________________________。
② 甲同学依据乙同学的实验设计思路,选用实验2中的试剂,运用控制变量的方法设计了更加严谨的实验,证明了平衡I2+I-![]() I3-的存在。
I3-的存在。
请你补充完整他设计的实验步骤:将实验2中下层紫红色溶液平均分成两份,分装于两支试管中,向试管1中加入1 mL水,振荡、静置;向试管2中_________________。两支试管中的现象分别为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对已经达到化学平衡的可逆反应4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g),其它条件不变,扩容减小压强,下列叙述正确的是 ( )
4NO(g) + 6H2O(g),其它条件不变,扩容减小压强,下列叙述正确的是 ( )
A.平衡向正反应方向移动,正反应速率增大,逆反应速率减小
B.平衡向正反应方向移动,K值增大
C.各物质的浓度都减小,产物的物质的量增加
D.正、逆反应速率都减小,向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烯雌酚是一种激素类药物,结构如图,下列有关叙述中不正确的是![]()
![]()
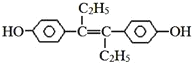
A.该有机物在一定条件下能发生加聚反应和氧化反应
B.该有机物可与NaOH和Na2CO3发生反应
C.1mol该有机物可以与5molBr2发生反应
D.该有机物分子中,最多有16个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是( )
A.3 g 3He含有的中子数为1NA
B.1 L 0.1 mol·L1磷酸钠溶液含有的![]() 数目为0.1NA
数目为0.1NA
C.1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D.常温下,11g CO2所含的共用电子对数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A. 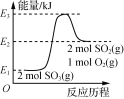 由图可知,2SO3(g)===2SO2(g)+O2(g) ΔH=(E1-E2)kJ·mol-1
由图可知,2SO3(g)===2SO2(g)+O2(g) ΔH=(E1-E2)kJ·mol-1
B. 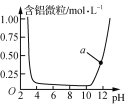 表示Al3+与OH-反应时溶液中含铝微粒浓度变化曲线,a点溶液中存在大量Al3+
表示Al3+与OH-反应时溶液中含铝微粒浓度变化曲线,a点溶液中存在大量Al3+
C. 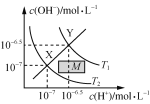 温度在T1和T2时水溶液中c(H+)和c(OH-)的关系,则阴影部分M内任意一点均满足c(H+)>c(OH-)
温度在T1和T2时水溶液中c(H+)和c(OH-)的关系,则阴影部分M内任意一点均满足c(H+)>c(OH-)
D. 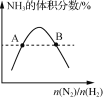 表示反应N2(g)+3H2(g)=2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
表示反应N2(g)+3H2(g)=2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种微生物燃料电池的结构示意图如下所示,关于该电池的叙述正确的是( )
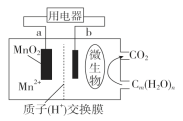
A. 电池工作时,电子由a流向b
B. 微生物所在电极区放电时发生还原反应
C. 放电过程中,H+从正极区移向负极区
D. 正极反应式为:MnO2+4H++2e-===Mn2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.56g铜粉加入100mL0.4mol·L-1的稀HNO3溶液中,加热充分反应后再加入100mL0.2mol·L-1的H2SO4溶液,继续加热,待充分反应后,所得溶液中Cu2+的物质的量浓度是(忽略溶液体积变化)( )
A.0.15mol·L-1B.0.2mol·L-1C.0.075mol·L-1D.0.45mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com