
【题目】对已经达到化学平衡的可逆反应4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g),其它条件不变,扩容减小压强,下列叙述正确的是 ( )
4NO(g) + 6H2O(g),其它条件不变,扩容减小压强,下列叙述正确的是 ( )
A.平衡向正反应方向移动,正反应速率增大,逆反应速率减小
B.平衡向正反应方向移动,K值增大
C.各物质的浓度都减小,产物的物质的量增加
D.正、逆反应速率都减小,向逆反应方向移动
科目:高中化学 来源: 题型:
【题目】“84”消毒液(工业利用Cl2与NaOH反应制得)可用于消毒和漂白,下列实验现象的分析不正确的是
实验操作 |
|
|
|
实验现象 | 混合后溶液的pH=9.9,短时间内未褪色,一段时间后蓝色褪去。 | 混合后溶液pH=5.0,蓝色迅速褪去,无气体产生。 | 混合后溶液pH=3.2,蓝色迅速褪去,并产生大量气体,使湿润的淀粉碘化钾试纸变蓝。 |
A.对比实验①和②,②中蓝色迅速褪去的原因是发生了反应ClO+H+═HClO
B.实验③中产生的气体是Cl2,由HClO分解得到:2HClO═Cl2↑+H2O
C.对比实验②和③,溶液的pH可能会影响ClO的氧化性或Cl的还原性
D.加酸可以提高“84”消毒液的漂白效果,但需要调控合适的pH才能安全使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班在实验室进行制取乙酸乙酯并对其性质进行探究的分组实验,主要步骤如下:
I.为探究乙酸乙酯的水解反应,某组同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴加热相同时间,观察到如下现象。
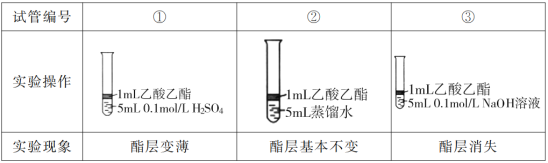
(1)设计实验①和②,是为了探究___对乙酸乙酯的水解的影响。
(2)试管③中反应的化学方程式是__。
Ⅱ.某组同学为验证醋酸、碳酸与苯酚三者酸性的强弱,经过慎重考虑,设计如下实验装置。已知A中装有醋酸,D中装有苯酚钠,请回答问题:
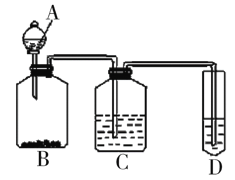
(1)C所盛放的药品是___,装置C的作用___。
(2)试描述能证明三种酸的酸性强弱的实验现象___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al与NaOH溶液反应的离子方程式为_____________________________________。
(2)下列实验能比较镁和铝的金属性强弱的是____________(填序号)。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/L AlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al (s)+3O2(g) =2Al2O3(s) ΔH1 = -3352 kJ/mol
Mn(s)+ O2(g) =MnO2 (s) ΔH2 = -521 kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是_____________________________。
(4)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + 2N2(g) + 6H2(g) ![]() Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是_________ mol/(L·min)。
②若按n(SiCl4) : n(N2) : n(H2) = 3 : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应______(填“增大”、“减小”或“不变”)。
(5)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp=_______________。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10-5mol·L-1,需调节pH为______以上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应X(s)+Y(g) W(g)+Z(g)△H>0,在一定体积不变的容器中反应达到平衡后,改变条件,反应速率(υ)随时间变化的情况如图所示。下列条件的改变与图中情况相符的是 ( )
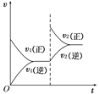
A.增加了X的物质的量B.降低了温度
C.增大了压强D.增大了Y的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A. H2S 的电离方程式:H2S+H2O![]() H3O++HS-
H3O++HS-
B. NaHCO3在水溶液中的电离方程式:NaHCO3= Na++H++CO32-
C. CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. HS-的水解方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种重要的化工原料,被广泛应用在工农业生产中。请运用所学知识解决下列问题:
是一种重要的化工原料,被广泛应用在工农业生产中。请运用所学知识解决下列问题:
已知反应:![]()
![]()
![]()
![]() 工业制取炭黑的方法之一是将甲烷隔绝空气加热到
工业制取炭黑的方法之一是将甲烷隔绝空气加热到![]() 进行裂解。该反应的热化学方程式为______。
进行裂解。该反应的热化学方程式为______。
![]() 容积固定为1L的密闭容器内充入
容积固定为1L的密闭容器内充入![]() 和
和![]() ,保持
,保持![]() 发生反应
发生反应![]() ,用压力计监测反应过程中容器内压强的变化如下表:
,用压力计监测反应过程中容器内压强的变化如下表:
反应时间 | 0 | 5 | 10 | 15 | 20 | 25 |
压强 |
|
|
|
|
|
|
则反应从开始到20min时,以CO浓度变化表示的平均反应速率![]() ______。
______。
![]() 对于反应
对于反应![]() 来说:
来说:
![]() 时,平衡常数
时,平衡常数![]() 。
。![]() 测得密闭容器中各物质达到平衡时物质的量浓度分别为:
测得密闭容器中各物质达到平衡时物质的量浓度分别为:![]() ,
,![]() ,
,![]() ,
,![]() ,则
,则![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ,判断依据是______。
,判断依据是______。
![]() 下列措施有利于提高反应混合气中
下列措施有利于提高反应混合气中![]() 含量的是______。
含量的是______。
A.使用催化剂 ![]() 升高温度
升高温度 ![]() 及时导出CO
及时导出CO![]() 增大反应体系的压强
增大反应体系的压强
![]() 一定条件下,将
一定条件下,将![]() 与
与![]() 按物质的量之比1:1置于恒容密闭容器中反应,下列能说明该反应达到平衡状态的是______。
按物质的量之比1:1置于恒容密闭容器中反应,下列能说明该反应达到平衡状态的是______。
A.![]()
![]()
B.体系中混合气体密度不变
C.![]() 与
与![]() 的转化率相等
的转化率相等
D.![]() 与
与![]() 物质的量之比不再改变
物质的量之比不再改变
E.反应体系压强不再改变
![]() 以甲烷为燃料的新型电池得到广泛应用。下图是甲烷燃料电池工作原理的示意图。
以甲烷为燃料的新型电池得到广泛应用。下图是甲烷燃料电池工作原理的示意图。
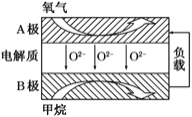
![]() 极上的电极反应式为______。
极上的电极反应式为______。
![]() 以该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到
以该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到![]() 标准状况
标准状况![]() 气体时,消耗甲烷的体积为______
气体时,消耗甲烷的体积为______![]() 标准状况
标准状况![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某同学在实验室中通过酸碱中和滴定实验测定盐酸的浓度。取20.00 mL待测盐酸放入锥形瓶中,并滴加23滴酚酞作指示剂,用标准的NaOH溶液进行滴定。重复上述滴定操作23次,记录数据如下:
实验编号 | NaOH溶液的浓度(molL-1) | 滴入NaOH溶液的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.10 | 20.00 |
2 | 0.10 | 22.00 | 20.00 |
3 | 0.10 | 21.90 | 20.00 |
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是_____________________。
(2)该实验滴定达到终点的标志是__________________________。
(3)根据上述数据,可计算出该盐酸的浓度约为_________。(保留两位有效数字)
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_________。
A滴定终点读数时俯视读数
B滴定过程中,不小心滴到桌子上几滴
C碱式滴定管尖嘴部分有气泡,滴定后消失
D锥形瓶水洗后未干燥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com