
【题目】铁氰化钾,化学式为K3[Fe(CN)6],主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)K3[Fe(CN)6]中所涉及的元素的基态原子核外未成对电子数最多的是_________(填元素名称),各元素的第一电离能由大到小的顺序为___________________。
(2)(CN)2分子中存在碳碳键,则分子中σ键与π键数目之比为_______。
(3)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253 K,沸点为为376 K,其固体属于_________晶体。
(4)下图是金属单质常见的两种堆积方式的晶胞模型。
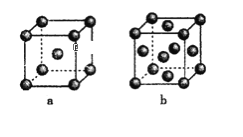
①铁采纳的是a堆积方式.铁原子的配位数为_____,该晶体中原子总体积占晶体体积的比值为_________(用含π的最简代数式表示)。
②常见的金属铝采纳的是b堆积方式,铝原子的半径为r pm,则其晶体密度为__________g·cm-3(用含有r、NA的最简代数式表示)。
【答案】铁 N>C>Fe>K 3:4 分子 8 ![]()
![]()
【解析】
(1)K的原子核外电子数为19,价电子排布式为4s1,Fe的价电子排布为3d64s2,C的价电子排布为2s22p2,N的价电子排布为2s22p3;非金属性越强,第一电离能越大,且N的2p电子半满为稳定结构;
(2)C≡N中含1个σ键、2个π键,HCN的结构式为H-C≡N;
(3)熔点为253K,沸点为为376K,可知熔沸点低;
(4)图a中Fe原子处于顶点与体心,是体心立方堆积,图b中Al原子处于顶点与面心,属于面心立方最密堆积,以此来解答。
(1)基态K原子核外电子排布简写式为[Ar]4s1,K3[Fe(CN)6]中所涉及的元素的基态原子核外未成对电子数最多的是Fe,各元素的第一电离能由大到小的顺序为N>C>Fe>K,故答案为:[Ar]4s1;Fe;N>C>Fe>K;
(2)(CN)2的结构式为N ≡C一C≡N,存在碳碳单键,则分子中σ键有3个,π键有4个,σ键与π键数目之比为3:4; 故答案为:3:4;
(3)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253K,沸点为为376K,其固体属于分子晶体;
(4)①铁的a堆积方式为体心立方堆积,与一个铁原子最近的铁原子距离为立方体边长的![]() ,这样的原子有八个,所以铁的配位数为8;如图所示:
,这样的原子有八个,所以铁的配位数为8;如图所示:
 ,晶胞中铁原子数为:8×
,晶胞中铁原子数为:8×![]() +1×=2,体心立方晶胞中r=
+1×=2,体心立方晶胞中r=![]() ,所以铁原子总体积=2×
,所以铁原子总体积=2×![]() =2×
=2×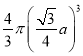 =
=![]() ,晶胞体积=a3,则该晶体中原子总体积占晶体体积的比值为
,晶胞体积=a3,则该晶体中原子总体积占晶体体积的比值为![]() 。
。
②②铝的b堆积方式为面心立方堆积,晶胞中含有Al原子数为:8×![]() +6×
+6×![]() =4,则晶胞质量为:
=4,则晶胞质量为:![]() g;该晶胞结构侧面可用如图表示:
g;该晶胞结构侧面可用如图表示: ,铝原子半径rpm=r×10-10cm,设晶胞边长为acm,晶胞边长a与铝原子的半径为r的关系为:2a2=(4r×10-10)2,解得a=
,铝原子半径rpm=r×10-10cm,设晶胞边长为acm,晶胞边长a与铝原子的半径为r的关系为:2a2=(4r×10-10)2,解得a=![]() r×10-10,所以晶胞体积为:(
r×10-10,所以晶胞体积为:(![]() r×10-10)3cm3,根据密度=质量÷体积,则晶体密度为:
r×10-10)3cm3,根据密度=质量÷体积,则晶体密度为:![]() g÷(
g÷(![]() r×10-10)3cm3=
r×10-10)3cm3=![]() g·cm-3。
g·cm-3。


科目:高中化学 来源: 题型:
【题目】在标准状况下有:①6.72LCH4,②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3。下列对这四种气体的描述不正确的是( )
A.体积②>③>①>④B.密度②>③>④>①
C.质量②>③>④>①D.氢原子个数①>③>④>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O和Na2O2组成的固体混合物溶于一定量的水中,充分反应后,收到标准状况下的气体1.12L,同时得到0.6molNaOH,求:
(1)原固体混合物中Na2O和Na2O2各是多少克?___、___
(2)所得溶液中应加入1mol/L的硫酸溶液多少毫升才能完全中和?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,在25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,曲线如图所示。有关粒子浓度大小关系的比较正确的是( )
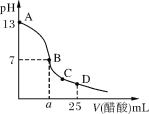
A.在A、B间任一点(不包含A、B两点),溶液中一定有:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.在B点,a>12.5,且有:c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.稀硫酸和氢氧化钡溶液反应:SO42-+Ba2+ =BaSO4↓
B.金属钠与水反应:Na+2H+=Na++H2↑
C.大理石与盐酸反应:CaCO3+2H+ =H2O+CO2↑+ Ca2+
D.氯气通入冷水中:Cl2+ H2O=ClO-+Cl-+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.32gNa2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况) 关系如图所示,下列说法中错误的是( )
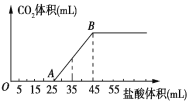
A.OA段发生反应的离子方程式为:H++OH-=H2O、CO32-+H+=HCO3-
B.A点溶液中的溶质为NaCl、NaHCO3
C.混合物中NaOH的质量0.60g
D.当加入35mL盐酸时,产生CO2的体积为224mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石灰石一石膏法脱硫是除去工业烟气中所含SO2的重要方法,其工艺分为两步:一是吸收SO2产生亚硫酸氢钙,二是氧化产生石膏。某校化学兴趣小组实验模拟该工艺,设计置如下:
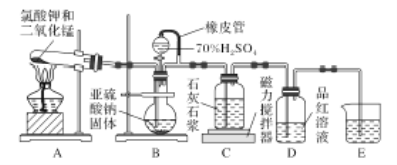
(1)装置B模拟产生含SO2的工业烟气,则E装置的作用是_______________。
(2)实验开始时,打开装置B中分液漏斗的活塞,向烧瓶中逐滴滴加硫酸,D中立即产生了明显的现象造成产生这一现象的原因是________。
A.该装置的气密性不够好
B.滴加硫酸的速率较快
C.使用的硫酸浓度较小
D.石灰石浆液中碳酸钙粉末的颗粒太小
(3)预计当装置C中________________的现象时,关闭装置B中分液漏斗的活塞,再点燃装置A处的酒精灯。实际实验过程中却始终未观察到C中产生这一现象,小组成员多次进行实验探究,最终发现是药品Na2SO3部分变质,请写出定性实验发现药品Na2SO3问题的有关操作及现象:取少量的亚硫酸钠固体于试管中,______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某另类元素周期表的一部分,下列说法正确的是( )
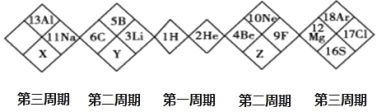
A. 单质的氧化性:X>Y>ZB. 简单阴离子的半径大小:X>Y>Z
C. Y 只有一种氢化物D. X 的最高价氧化物对应的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. N2![]() NO2
NO2![]() HNO3
HNO3
B. 石油![]() CH3CH3
CH3CH3![]() CH2BrCH2Br
CH2BrCH2Br
C. Al ![]() Al(NO3)3(aq)
Al(NO3)3(aq)![]() Al(OH)3(s)
Al(OH)3(s)
D. CH2=CH2 ![]() CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com