
已知:①CH3OH (g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是 ( )。
A.CH3OH转变成H2的过程一定要吸收能量
B.①反应中,反应物的总能量高于生成物总能量
C.根据②推知反应:CH3OH(l)+ O2(g)===CO2(g)+2H2(g)的
O2(g)===CO2(g)+2H2(g)的
ΔH>-192.9 kJ·mol-1
D.反应②中的能量变化如下图所示

科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第11讲有机化学基础练习卷(解析版) 题型:填空题
某芳香烃A可以从煤干馏得到的煤焦油中分离出来,以A为原料可以合成聚邻氨基苯甲酸、扁桃酸等物质,其合成流程如下。

已知:
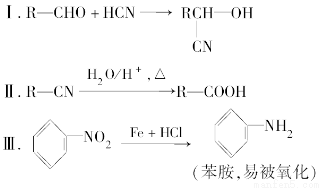
请回答下列问题:
(1)C的分子式为________。
(2)下列对相关反应类型的判断合理的是________(填序号)。
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
Ⅰ | 加成 | 水解 | 还原 | 取代 | 还原 | 氧化 | 加聚 |
Ⅱ | 加成 | 消去 | 还原 | 加成 | 氧化 | 还原 | 缩聚 |
Ⅲ | 取代 | 水解 | 氧化 | 加成 | 氧化 | 还原 | 缩聚 |
Ⅳ | 取代 | 消去 | 氧化 | 取代 | 还原 | 氧化 | 加聚 |
(3)写出反应③的化学方程式:_____________________________________。
(4)扁桃酸有多种同分异构体,其中既能与氯化铁溶液发生显色反应,又能与碳酸氢钠溶液反应产生气泡的同分异构体有________种,写出其中一种的结构简式:________。
(5)以芳香烃A为主要原料,还可以通过下列合成路线合成阿司匹林和冬青油:

①冬青油的结构简式为__________________________________________。
②写出反应Ⅴ的化学方程式:_______________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题7电解质溶液练习卷(解析版) 题型:填空题
某二元酸(化学式用H2B表示)在水中的电离方程式是H2B===H++HB-;HB- H++B2-。回答下列问题。
H++B2-。回答下列问题。
(1)Na2B溶液显_____(填“酸性”、“中性”或“碱性”),理由是_______(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是____。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1 mol·L-1 H2B溶液中的氢离子的物质的量浓度可能____0.11 mol·L-1(填“<”、“>”或“=”),理由是_____。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是_______。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题6化学反应速率和化学平衡练习卷(解析版) 题型:选择题
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是 ( )。
2Z(g)一定达到化学平衡状态的是 ( )。
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题5化学反应与能量变化练习卷(解析版) 题型:填空题
保护环境已成为当前和未来的一项全球性重大课题。为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促使燃料循环使用的构想,如图所示:

过程Ⅰ可用如下反应表示:
①2CO2 2CO+O2 ②2H2O===2H2+O2 ③2N2+6H2O
2CO+O2 ②2H2O===2H2+O2 ③2N2+6H2O 4NH3+3O2 ④2CO2+4H2O
4NH3+3O2 ④2CO2+4H2O 2CH3OH+3O2 ⑤2CO+4H2O
2CH3OH+3O2 ⑤2CO+4H2O ________+3O2
________+3O2
请回答下列问题:
(1)过程Ⅰ的能量转化形式为________能转化为________能。
(2)请完成第⑤个反应的化学方程式:____________________。
(3)上述转化过程中,ΔH1和ΔH2的关系是________。
(4)断裂1 mol化学键所需的能量见下表:
共价键 | H—N | H—O | N≡N | O===O |
断裂1 mol化学键所需能量/(kJ·mol-1) | 393 | 460 | 941 | 499 |
常温下,N2与H2O反应生成NH3的热化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题4物质结构与元素周期律练习卷(解析版) 题型:填空题
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大。已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2。请回答:
(1)元素C在周期表中的位置是________。
(2)元素D的单质与金属钠反应生成的化合物可作潜水面具中的供氧剂,这种化合物与水反应的离子方程式________________________________。
(3)D和E两种元素相比较,其原子得电子能力较强的是________(写名称)。
以下说法中,可以证明上述结论的是__________(填写编号)。
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素氢化物的水溶液的酸性
(4)元素A、D、E与钠元素可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中反应的离子方程式是____________________________。
(5)由元素A、B、D组成的一元酸X为日常生活中的调味剂,元素A、F组成的化合物为Y。在等体积、等pH的X、Y的溶液中分别加入等质量的锌粉,反应后若最后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X________Y(填“>”、“=”或“<”)。
(6)元素F的单质常温下是一种气体,工业上主要是通过电解其钠盐的饱和溶液的方法获得该气体,假定装入的饱和溶液为100 mL(电解前后溶液体积变化可忽略),当测得阴极上产生11.2 mL(标准状况)气体时停止通电,将溶液摇匀,此时溶液的pH为________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题4物质结构与元素周期律练习卷(解析版) 题型:选择题
X、Y、Z是位于不同周期的三种短周期元素,且原子序数逐渐增大,X、Z位于同一主族,三种元素可以形成原子个数比为1∶1∶1的化合物W。下列推测正确的是 ( )。
A.元素Z的氧化物一定属于碱性氧化物
B.原子半径:X<Y<Z
C.三种元素中,Y的金属性最强
D.Y、Z都能形成含氧酸,且前者的酸性比后者强
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题2常用化学计量--物质的量练习卷(解析版) 题型:选择题
在T ℃时,将a gNH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,其中含有NH的物质的量为b mol。下列叙述中正确的是( )。
A.溶质的质量分数为w= ×100%
×100%
B.溶质的物质的量浓度c= mol·L-1
mol·L-1
C.溶液中c(OH-)= mol·L-1
mol·L-1
D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5 w
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题13化学实验综合应用练习卷(解析版) 题型:实验题
某研究小组欲探究SO2的化学性质,设计了如下实验方案。

(1)在B中检验SO2的氧化性,则B中所盛试剂可为________。
(2)在C中装FeCl3溶液,检验SO2的还原性,则C中反应的离子方程式为_____________________________________________________。
(3)在D中装新制漂白粉浓溶液。通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分进行了探究。请回答下列问题:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1盐酸、0.5 mol·L-1H2SO4溶液、0.5 mol·L-1BaCl2溶液、品红溶液、新制澄清石灰水。
(ⅰ)假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为________;
假设三:该白色沉淀为上述两种物质的混合物。
(ⅱ)基于假设一,填写下表:
实验操作 | 预期现象和结论 |
将D中沉淀过滤,洗涤干净备用 |
|
用另一干净试管取少量沉淀样品,加入______________ | _________________________ |
(ⅲ)若假设二成立,试写出生成该白色沉淀的化学方程式:
__________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com