
【题目】六氟化硫分子(如下图)呈正八面体,难以水解,在电器工业方面有着广泛用途。下列有关SF6的推测正确的是( )

A.SF6易燃烧生成二氧化硫
B.SF6是极性分子
C.SF6中各原子均达到 8 电子稳定结构
D.高温条件下,SF6微弱水解生成H2SO4和HF
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一新型、高效、无毒的多功能水处理剂。
(资料)K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4。
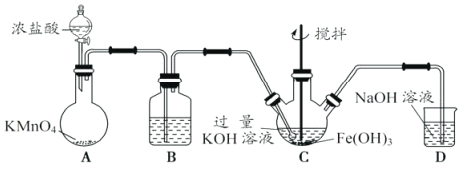
①A为制取氯气发生装置,其中盛放浓盐酸的仪器名称为___________。
②除杂装置B中的试剂为___________。
③C为制备K2FeO4装置,KOH溶液过量的原因是___________。
④D为尾气处理装置,发生反应的离子方程式为___________。
(2)探究 K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黃绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
①由方案I中溶液变红可知a中含有___________。该离子的产生___________(填“能”或“不能”)判断一定是由K2FeO4被Cl-还原而形成的。
②方案Ⅱ用KOH溶液洗涤的目的是___________。方案Ⅱ得出氧化性:Cl2___________FeO42-(填“>”或“<”)
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:_______ FeO42-+______H+===_______O2↑+________Fe3++________(配平及完成上述离子方程式)________。现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为___________。(计算结果保留到0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成密蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:

相对分子质量 | 密度/(g·cm3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1 .0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
实验步骤:在A中加入4.4g异戊醇![]() 、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液洗涤;分出的产物再加入少量无水Na2SO4固体,静止片刻。过滤除去Na2SO4固体,讲行蒸馏纯化。收集140~143°C馏分,得到乙酸异戊酯3.9g。回答下列问题:
、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液洗涤;分出的产物再加入少量无水Na2SO4固体,静止片刻。过滤除去Na2SO4固体,讲行蒸馏纯化。收集140~143°C馏分,得到乙酸异戊酯3.9g。回答下列问题:
(1)实验中制备乙酸异戊酯的化学方程式为_________________。
(2)仪器B的名称是_______________,作用是____________。
(3)在洗涤操作中饱和碳酸氢钠溶液的主要作用是______________。
(4)实验中加入少量无水Na2SO4的目的是_________________________。
(5)实验中加过量乙酸的目的是___________________________。
(6)本实验的产率是_______________(填标号)。
a.30% b.40% c.50% d.60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所涉及的物质均为中学化学中的常见物质,其中C、D、E为单质,E为固体,F为有磁性的化合物。它们之间存在如下关系(反应中生成的水及次要产物均已略去):

(1)写出下列物质的化学式:B________,E________。
(2)指出MnO2在相关反应中的作用:反应①中是________剂,反应②中是________剂。
(3)若反应①是在加热条件下进行,则A是________(填化学式);若反应①是在常温条件下进行,则A是________(填化学式);如在上述两种条件下得到等质量的C单质,反应中转移的电子数之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数,下列说法正确的是
A.28g的CO与CO2混合物中含有的碳原子数为NA
B.标准状况下,22.4 L水中含有的氧原子数为NA
C.0.5molL﹣1的AlCl3溶液中所含Cl- 数目为1.5NA
D.1mol钠在足量氧气中燃烧生成Na2O2,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用磷酸铁锂电池其有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应式为M1-xFexPO4+e-+Li+=LiM1-x FexPO4,其原理如图所示,下列说法正确的是( )

A.放电时,电流由石墨电极流向磷酸铁锂电极
B.电池总反应为M1-xFexPO4+LiC6![]() Li M1-xFexPO4+6C
Li M1-xFexPO4+6C
C.放电时,负极反应式为LiC6-e-=Li++6C
D.充电时,Li+移向磷酸铁锂电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是

A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中n(NH4+)=0.2 mol
C.溶液中一定不含CO32-,可能含有SO42-和NO3-
D.n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯净干燥的氯气与熔融金属锡反应可制备 SnCl4,某化学小组的同学设计了如下实验装置进行制备。

已知:①金属锡熔点为 231℃,化学活泼性与铁相似;②SnCl4 的沸点为 114℃;③SnCl4 易与水反应。
请根据上图装置回答:
(1)装置Ⅳ中发生反应的化学方程式为__________________________。
(2)试管II中的试剂是___________________,装置 V 的作用是______________。
(3)裝置Ⅵ最好选用下列装置中的______________________(填标号)。

(4)实验结束后,欲回收利用装置Ⅰ中未反应完的 MnO2,需要的分离方法___________。
(5)为了顺利完成实验,点燃酒精灯的正确操作是___________________(填字母)。
A.先点燃 I 处酒精灯,后点燃Ⅳ处酒精灯
B.先点燃Ⅳ处酒精灯,后点燃 I 处酒精灯
C.同时点燃 I、Ⅳ两处酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构式可用“键线式”简化表示。如CH3一CH=CH一CH3可简写为![]() 。有机物X的键线式为:
。有机物X的键线式为: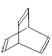 。下列说法不正确的是
。下列说法不正确的是
A.X与苯中碳元素的质量分数相同
B.有机物Y是X的同分异构体,且属于芳香烃,能使溴水褪色,则Y为苯乙烯
C.X能使酸性高锰酸钾溶液褪色
D.X 与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有四种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com