
(14分) “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000 kJ·m-3的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:
C(s)+O2(g)=CO2(g) ΔH1=—393.5 kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(g) ΔH2=—483.6 kJ·mol-1 ②
C(s)+H2O(g)=CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1 ③
则反应CO(g)+H2(g) +O2(g)=H2O(g)+CO2(g),ΔH= kJ·mol-1。标准状况下的煤炭气(CO、H2)33.6 L与氧气完全反应生成CO2和H2O,反应过程中转移 mol e-。
(2)工作温度650℃的熔融盐燃料电池,是用煤炭气(CO、H2)作负极燃气,空气与CO2的混合气体在正极反应,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;则该电池的正极反应式为 。
(3)密闭容器中充有10mol CO与20 mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如右图所示。
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为VAL,则该温度下的平衡常数K= ;A、B两点时容器中物质的物质的量之比为n(A)总:n(B)总= 。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是 。
A 降温 B 加压 C 使用催化剂 D 将甲醇从混合体系中分离出来
科目:高中化学 来源:2011-2012学年湖南师大附中高二12月阶段检测化学试卷 题型:填空题
(14分) “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000 kJ·m-3的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:
C(s)+O2(g)=CO2(g) ΔH1=—393.5 kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(g) ΔH2=—483.6 kJ·mol-1 ②
C(s)+H2O(g)=CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1 ③
则反应CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= kJ·mol-1。标准状况下的煤炭气(CO、H2)33.6 L与氧气完全反应生成CO2和H2O,反应过程中转移 mol e-。
(2)工作温度650℃的熔融盐燃料电池,是用煤炭气(CO、H2)作负极燃气,空气与CO2的混合气体在正极反应,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;则该电池的正极反应式为 。
(3)密闭容器中充有10 mol CO与20 mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)  CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如右图所示。
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如右图所示。
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为VAL,则该温度下的平衡常数K= ;A、B两点时容器中物质的物质的量之比为n(A)总:n(B)总= 。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是 。
A 降温 B 加压 C 使用催化剂 D 将甲醇从混合体系中分离出来
查看答案和解析>>
科目:高中化学 来源:2013届湖南师大附中高二12月阶段检测化学试卷 题型:填空题
(14分) “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000 kJ·m-3的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:
C(s)+O2(g)=CO2(g) ΔH1=—393.5 kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(g) ΔH2=—483.6 kJ·mol-1 ②
C(s)+H2O(g)=CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1 ③
则反应CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= kJ·mol-1。标准状况下的煤炭气(CO、H2)33.6 L与氧气完全反应生成CO2和H2O,反应过程中转移 mol e-。
(2)工作温度650℃的熔融盐燃料电池,是用煤炭气(CO、H2)作负极燃气,空气与CO2的混合气体在正极反应,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;则该电池的正极反应式为 。
(3)密闭容器中充有10
mol CO与20 mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)  CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如右图所示。
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如右图所示。
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为VAL,则该温度下的平衡常数K= ;A、B两点时容器中物质的物质的量之比为n(A)总:n(B)总= 。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是 。
A 降温 B 加压 C 使用催化剂 D 将甲醇从混合体系中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(1)C1化学是指从一个碳原子的化合物(如CH4,CO,CO2,CH3OH,HCHO等)出发合成各种化学品的技术。从煤、天然气制合成气再进一步制备各种化工产品和洁净燃料,已成为当今化学工业发展的必然趋势。其中甲醇是C1化学的基础。
①CO与H2按一定比例可生成乙二醇,则n(CO)/n(H2)=_____________(填数字)。
②若汽油平均组成用CmHn表示,则合成汽油控制n(CO)/n(H2)=(用m、n表示)。
③甲醇在一定条件下与CO、H2作用生成有机物A,A发生加聚可生成高分子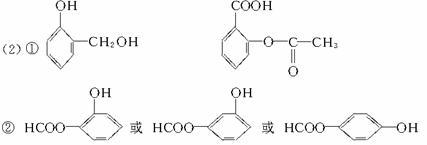 写出生成A的化学方程式:_________________________________。
写出生成A的化学方程式:_________________________________。
(2)已知醇醛在一定条件下能发生缩合反应,示例如下:
已知:
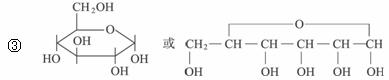
①1827年人们就发现有机物A,它的分子式为C13H18O7,与一分子水作用,水解生成B和C。
②B能发生银镜反应,B也可由淀粉水解得到,B的分子式为C6H12O6。
③C遇氯化铁溶液能发生显色反应,1 mol C与足量钠反应可产生1 mol H2。
④C在适当的条件下用适当氧化剂氧化,可得D,D的分子式为C7H6O3,相对分子质量D比C大14。
⑤D有两个取代基,但不是间位,它与Br2在催化剂作用下发生一溴取代,产物有四种,D能与碳酸氢钠溶液反应。
⑥D与乙酸酐〔(CH3CO)2O〕反应,可得常见药物E和乙酸,E能与碳酸氢钠反应放出二氧化碳。
试回答下列问题:
①写出结构简式:C_________________,E_________________。
②写出与D互为同分异构体,含有苯环且含有酯结构的结构简式:_________________(只需写一种)。
③B通常以六元环状结构存在,写出B的环状结构简式:_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com