
【题目】卫生部曾发布公告:禁止在面粉生产过程中添加过氧化钙(CaO2)等食品添加剂。下列有关过氧化钙(CaO2)的叙述错误的是
A. CaO2具有氧化性,对面粉可能具有增白作用
B. 过氧化钙固体中阴阳离子个数之比为2:1
C. CaO2和CO2反应时,每产生1molO2转移2mol电子
D. CaO2和水反应的化学方程式为:2CaO2+2H2O═2Ca(OH)2+O2↑
【答案】B
【解析】
结合过氧化钠的性质分析。过氧化物,具有氧化性,具有增白作用;过氧化钙固体中阴阳离子分别是![]() 、
、![]() ;CaO2和CO2反应的化学方程式为2CaO2+2CO2=2CaCO3+O2;CaO2和水反应生成氢氧化钙和氧气。
;CaO2和CO2反应的化学方程式为2CaO2+2CO2=2CaCO3+O2;CaO2和水反应生成氢氧化钙和氧气。
CaO2是过氧化物,具有氧化性,具有增白作用,故A正确;过氧化钙固体中阴阳离子分别是![]() 、
、![]() ,阴阳离子个数之比为1:1,故B错误;CaO2和CO2反应的化学方程式为2CaO2+2CO2=2CaCO3+O2,所以每产生1molO2转移2mol电子,故C正确;CaO2和水反应生成氢氧化钙和氧气,反应方程式是2CaO2+2H2O═2Ca(OH)2+O2↑,故D正确;选B。
,阴阳离子个数之比为1:1,故B错误;CaO2和CO2反应的化学方程式为2CaO2+2CO2=2CaCO3+O2,所以每产生1molO2转移2mol电子,故C正确;CaO2和水反应生成氢氧化钙和氧气,反应方程式是2CaO2+2H2O═2Ca(OH)2+O2↑,故D正确;选B。


科目:高中化学 来源: 题型:
【题目】向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如下图所示,则甲、乙、丙中注入的液体分别是( )

A. ①②③ B. ③②① C. ②①③ D. ①③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 凡是能溶于水有甜味的物质都属于糖类 B. 糖类都能发生水解反应
C. 油脂、糖类都属于高分子化合物 D. 葡萄糖属于单糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温时CH3COOH的电离平衡常数Ka=1.75×105,NH3·H2O的电离平衡常数Kb=1.75×105。常温时,向10 mL浓度均为0.01mol·L1的NaOH和氨水混合溶液中,逐滴加入0.01mol·L1的 CH3COOH 溶液,混合溶液的pH与加入CH3COOH的体积V之间的变化曲线如图所示,下列有关说法正确的是

A. a 点溶液的pH<12
B. b 点时水的电离程度最大
C. c 点处的微粒间存在:c(CH3COO)=c(NH4+)+c(NH3·H2O)
D. d 点处的微粒间存在:c(CH3COO)>c(H+)>c(Na+)>c(NH4+)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M 有抗菌作用,其合成路线如下图所示:

已知:①![]()
②
③
(1)M的分子式是______________,A的化学名称是__________________。
(2)G的结构简式是___________,F中含氧官能团的名称是_______________。
(3)由A生成B和由G生成H 的反应类型分别是___________、____________。
(4)由C生成D 的化学方程式是_________________。
(5)E 的同分异构体中,符合下列条件的结构共有___________种。
①苯的二元取代物 ②与E 具有相同的官能团 ③能发生银镜反应和水解反应
(6)结合题给信息,以甲苯为原料制备化合物![]() ,设计合成路线(其他试剂任选)。 _________
,设计合成路线(其他试剂任选)。 _________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和肼(N2H4)都是氮元素的重要氢化物,在工农业生产、生活中有广泛应用。
(1)工业中常用以下反应合成氨:N2+3H2![]() 2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示:
2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示:
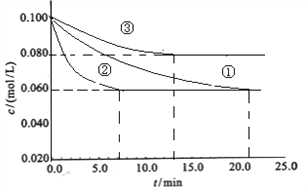
装罝③仅有一个反应条件与①不同,该条件为_______________,实验②平衡时H2的转化率为_____________;
(2)肼是一种具有强还原性的无色油状液体,可用作燃料。
①在火箭推进器中装有胼(N2H4)和液态H2O2,已知0.4mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6kJ的热量。该反应的热化学方程式为_____________________________________________________。
②肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%-30%的KOH溶液。已知肼在101kPa、25℃条件下的燃烧热为624kJ·mol-1,如果此燃料电池的能量转化率为50%,当消耗空气2.24L(已折算为标准状况下体积)时,则此电池产生的电能约为_________kJ。(假设空气中氧气的体积含量为20%,产物为液态水)

(3)肼又称“联氨”,为二元弱碱,在水中的电离方程式与氨相似,肼第一步电离反应的平衡常数值为____________.(已知:N2H4+H+![]() N2H5+ 的K=8.7×107;KW =1.0×10-14)
N2H5+ 的K=8.7×107;KW =1.0×10-14)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某重要有机合成中间体X的结构如图所示,有关该物质的说法正确的是

A. X分子中所有碳原子一定共面
B. X可以使溴水、酸性KMnO4褪色,且原理不相同
C. 标况下1 molX分别和足量Na和NaHCO3反应,生成气体体积相同
D. X与庚二酸(![]() )互为同分异构体
)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)①H2 + CuO ![]() Cu + H2O
Cu + H2O
②CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
③3S + 6NaOH ![]() 2Na2S + Na2SO3 + 3H2O
2Na2S + Na2SO3 + 3H2O
④NH4NO3 + Zn = ZnO + N2↑+ 2H2O
⑤Cu2O + 4HCl = 2HCuCl2 + H2O
上述反应中,属于氧化还原反应的是__________________________(填序号)
(2)SeO2、KI和HNO3可发生反应:SeO2+KI+HNO3→Se+I2+KNO3+H2O,配平该反应的化学方程式并用双线桥法标出电子转移的方向和数目:____________________________。
(3)在反应 KIO3 + 6HI = 3I2 + KI + 3H2O中,氧化剂与还原剂的物质的量之比为__________。
Ⅱ.已知:
① 2H2O + Cl2 + SO2 = H2SO4 + 2HCl ② 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
(4)根据以上两个反应可以得出氧化剂和还原剂的强弱顺序,请写出由KMnO4、K2SO4 、MnSO4 、SO2、H2O、H2SO4 这六种物质组成的氧化还原反应的方程式并配平:_______________________。
在反应②中,若有18.25g HCl被氧化,求:
(5)转移的电子数为:_______________。
(6)标况下生成Cl2的体积(请列式计算)_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com