
【题目】Ⅰ.(1)①H2 + CuO ![]() Cu + H2O
Cu + H2O
②CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
③3S + 6NaOH ![]() 2Na2S + Na2SO3 + 3H2O
2Na2S + Na2SO3 + 3H2O
④NH4NO3 + Zn = ZnO + N2↑+ 2H2O
⑤Cu2O + 4HCl = 2HCuCl2 + H2O
上述反应中,属于氧化还原反应的是__________________________(填序号)
(2)SeO2、KI和HNO3可发生反应:SeO2+KI+HNO3→Se+I2+KNO3+H2O,配平该反应的化学方程式并用双线桥法标出电子转移的方向和数目:____________________________。
(3)在反应 KIO3 + 6HI = 3I2 + KI + 3H2O中,氧化剂与还原剂的物质的量之比为__________。
Ⅱ.已知:
① 2H2O + Cl2 + SO2 = H2SO4 + 2HCl ② 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
(4)根据以上两个反应可以得出氧化剂和还原剂的强弱顺序,请写出由KMnO4、K2SO4 、MnSO4 、SO2、H2O、H2SO4 这六种物质组成的氧化还原反应的方程式并配平:_______________________。
在反应②中,若有18.25g HCl被氧化,求:
(5)转移的电子数为:_______________。
(6)标况下生成Cl2的体积(请列式计算)_______。
【答案】①③④ 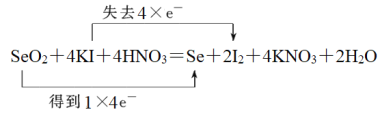 1:5 2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4 0.5NA或3.01×1023 5.6L
1:5 2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4 0.5NA或3.01×1023 5.6L
【解析】
Ⅰ.(1)反应前后有元素化合价升降的反应是氧化还原反应,据此判断。
(2)根据反应中元素的化合价变化情况,结合电子得失守恒解答。
(3)根据反应中元素的化合价变化情况,结合电子得失守恒解答。
Ⅱ.根据氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性,判断出氧化性、还原性强弱,根据氧化还原反应规律书写方程式,结合方程式和元素的化合价变化计算。
(1)①反应H2 + CuO ![]() Cu + H2O中H元素化合价升高,Cu元素化合价降低,属于氧化还原反应;
Cu + H2O中H元素化合价升高,Cu元素化合价降低,属于氧化还原反应;
②反应CaCO3 + 2HCl=CaCl2 + CO2↑ + H2O中元素的化合价均没有发生变化,不是氧化还原反应;
③反应3S + 6NaOH ![]() 2Na2S + Na2SO3 + 3H2O中S元素的化合价部分升高,部分降低,属于氧化还原反应;
2Na2S + Na2SO3 + 3H2O中S元素的化合价部分升高,部分降低,属于氧化还原反应;
④反应NH4NO3 + Zn=ZnO + N2↑+ 2H2O中Zn元素化合价升高,铵根中N元素化合价升高,硝酸根中N元素化合价降低,属于氧化还原反应;
⑤反应Cu2O + 4HCl=2HCuCl2 + H2O中元素的化合价均没有发生变化,不是氧化还原反应;
则上述反应中,属于氧化还原反应的是①③④;
(2)反应中Se元素化合价从+4价降低到0价得到4个电子,I元素化合价从-1价升高到0价,失去1个电子,根据电子得失守恒可知转移电子是4个,因此配平该反应的化学方程式并用双线桥法标出电子转移的方向和数目为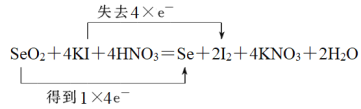 。
。
(3)在反应KIO3 + 6HI=3I2 + KI + 3H2O中碘酸钾中碘元素化合价从+5价降低到0价,得到5个电子,碘酸钾是氧化剂,HI中碘元素化合价从-1价升高到0价,失去1个电子,HI是还原剂,根据电子得失守恒可知氧化剂与还原剂的物质的量之比为1:5。
Ⅱ.(4)①反应2H2O + Cl2 + SO2=H2SO4 + 2HCl中氯气是氧化剂,二氧化硫是还原剂,硫酸是氧化产物,所以氧化性是Cl2>H2SO4;②反应2KMnO4 + 16HCl=2KCl + 2MnCl2 + 5Cl2↑ + 8H2O中高锰酸钾是氧化剂,氯化氢是还原剂,氯气是氧化产物,所以氧化性是KMnO4>Cl2↑,因此由KMnO4、K2SO4、MnSO4、SO2、H2O、H2SO4这六种物质组成的氧化还原反应中氧化剂是高锰酸钾,二氧化硫是还原剂,则反应的方程式为2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4。
(5)在反应②中,若有18.25g HCl被氧化,即被氧化的氯化氢的物质的量是18.25g÷36.5g/mol=0.5mol。反应中氯元素化合价从-1价升高到0价,则转移电子的物质的量是0.5mol×1=0.5mol,电子数为0.5NA。
(6)根据氯原子守恒可知生成氯气是0.5mol÷2=0.25mol,在标况下的体积为0.25mol×22.4L/mol=5.6L。


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】卫生部曾发布公告:禁止在面粉生产过程中添加过氧化钙(CaO2)等食品添加剂。下列有关过氧化钙(CaO2)的叙述错误的是
A. CaO2具有氧化性,对面粉可能具有增白作用
B. 过氧化钙固体中阴阳离子个数之比为2:1
C. CaO2和CO2反应时,每产生1molO2转移2mol电子
D. CaO2和水反应的化学方程式为:2CaO2+2H2O═2Ca(OH)2+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解制碱的技术是用离子交换膜法。请回答下列问题:
(1)电解精制食盐水,电解槽中的阳离子交换膜把电解槽隔成了阴极室和阳极室,它只允许阳离子通过,而不允许_____________(填离子符号)和气体通过。
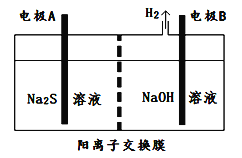
(2)氯碱工业中获得的烧碱可以吸收有毒气体H2S,吸收后的溶液加入到如图所示的电解池的阳极区进行电解以获取单质硫。
①Na2S溶液显碱性的原因(离子方程式):____________________________________________________________。
②电极A应该与直流电源的____________相连。A电极反应为________________________________________________。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节电、节能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出。
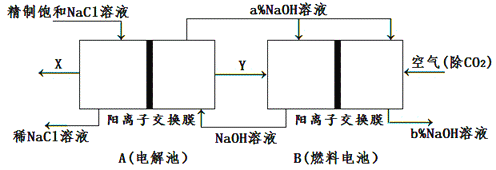
①图示中电极产物X、Y分别是____________、____________(填化学式)。图示中氢氧化钠溶液质量分数大小:a%______b%(填“﹥”“﹤”或“=”)。
②燃料电池B中正极的电极反应:_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质用途的叙述中不正确的是( )
A.钠和钾的合金可用于快中子反应堆作热交换剂
B.FeCl3溶液能与Cu反应,可用于蚀刻印刷电路板
C.明矾溶于水后能产生Al(OH)3胶体,可用作净水剂
D.在医疗上,可用碳酸钠治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在下图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,m、n均为空气的主要成分,p是W的单质,其余为由上述的两种或三种元素组成的化合物;u的水溶液具有漂白性;t和v均为一元强酸。

下列说法正确的是
A. 物质u中既含共价键又含离子键
B. 常温常压下,r与s均为无色气体
C. 简单气态氢化物的热稳定性:Z
D. X、Y、Z三种元素形成化合物的水溶液可能呈酸性,也可能呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以反应5H2C2O4+2MnO4-+6H+===10CO2↑+2Mn2++8H2O为例探究“外界条件对化学反应速率的影响”。实验时,分别量取H2C2O4溶液和酸性KMnO4溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
下列说法不正确的是
A. 实验①、②、③所加的H2C2O4溶液均要过量
B. 实验①测得KMnO4溶液的褪色时间为40 s,则这段时间内平均反应速率υ(KMnO4)=2.5×10-4mol·L-1·s-1
C. 若生成a L CO2(标准状况),该反应转移的电子数为aNA/22.4
D. 实验①和②起初反应均很慢,过了一会儿速率突然增大,可能是生成的Mn2+对反应起催化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液分别滴加到两种一元弱酸HA和HB中,两种混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. 电离常数:Ka(HB)>Ka(HA)
B. Ka(HA)的数量级为10-5
C. 当HA与NaOH溶液混合至中性时:c(A-)=c(HA)
D. 等浓度等体积的HA和NaB混合后所得溶液中:c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com