
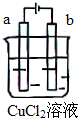
| A. | 电极a表面呈红色 | |
| B. | 电极b表面有气泡生成 | |
| C. | 电子由电源的负极沿导线流向电极b | |
| D. | 该装置能量转化形式为化学能转化为电能 |
分析 该装置是电解池,用石墨作电极电解氯化铜溶液时,阳极上电极反应式为2Cl--2e-=Cl2↑、阴极反应式为Cu2++2e-=Cu,电子从负极沿导线流向阴极、从阳极沿导线流向正极,据此分析解答.
解答 解:A.该装置是电解池,用石墨作电极电解氯化铜溶液,a是阳极,阳极上电极反应式为2Cl--2e-=Cl2↑,所以该电极上有黄绿色气体生成,故A错误;
B.b是阴极,阴极反应式为Cu2++2e-=Cu,所以b电极上有红色物质析出,故B错误;
C.电子从负极沿导线流向阴极b、从阳极a沿导线流向正极,故C正确;
D.该装置是电解池,是将电能转化为化学能的装置,故D错误;
故选C.
点评 本题考查电解原理,为高频考点,明确各个电极上发生的反应、电解池和原电池区别、电子流向是解本题关键,注意:电子不进入电解质溶液,电解质溶液中是通过阴阳离子定向移动形成电流的.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
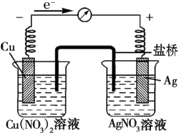 某探究小组将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag (s)设计成原电池,某时刻的电子流向及电流表(A)指针偏转方向如图所示.
某探究小组将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag (s)设计成原电池,某时刻的电子流向及电流表(A)指针偏转方向如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
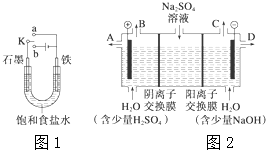 (1)某课外活动小组同学用图1装置进行实验,试回答下列问题:
(1)某课外活动小组同学用图1装置进行实验,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.
A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.如图为该电池放电过程示意图,Cn为石墨烯,下列说法不正确的是( )
最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.如图为该电池放电过程示意图,Cn为石墨烯,下列说法不正确的是( )| A. | 充电时,每生成1mol Al,电解质溶液中会增加7molAlCl4- | |
| B. | 放电时,电解质中的阳离子(EMl+)未发生反应 | |
| C. | 放电时,负极反应方程式为Al+7AlCl4--3e-═4Al2Cl7- | |
| D. | 充电时,Cn为阳极,电极方程式为Cn+AlCl4--e-═Cn[AlCl4] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | N2 | O2 | 将气体缓缓通过足量的灼热铜网 |
| B | NaCl | KNO3 | 冷却热饱和溶液,过滤 |
| C | Cu | Zn | 加入足量稀盐酸,充分反应后过滤,洗涤,干燥 |
| D | FeCl2溶液 | CuCl2 | 加入足量铁粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L CHCl3含氯原子数为3NA | |
| B. | 100mL 1 mol•L-1醋酸溶液中的氢原子数为0.4NA | |
| C. | 常温常压下,11.2g乙烯中共用电子对数为2.4NA | |
| D. | 6.4 g CaC2晶体中所含的离子总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
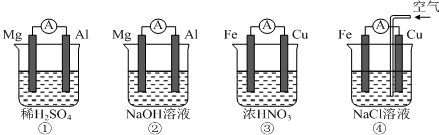
| A. | ①中Mg作负极,电子流向:Mg→稀硫酸→Al | |
| B. | ②中Al作负极,OH?迁移方向:Al→外电路→Mg | |
| C. | ③中Fe作正极,电极反应式:2H++2e?═H2↑ | |
| D. | ④中Cu作正极,电极反应式:O2+4e?+2H2O═4OH? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:钠>硫>氯 | |
| B. | 最高价氧化物对应的水化物的酸性:HClO4>H2SO4>H3PO4 | |
| C. | 热稳定性:碘化氢>溴化氢>氯化氢 | |
| D. | 最高正化合价:氯>硫>磷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com