
【题目】新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式为:

下列说法不正确的是
A. 上述反应为氧化还原反应 B. 滴定时可用淀粉溶液作指示剂
C. 滴定时应剧烈振荡锥形瓶使反应充分 D. 脱氢维生素C的分子式为C6H6O6
科目:高中化学 来源: 题型:
【题目】小王要制备纯净的二氧化碳气体,可供选用的仪器如图所示。可供选用的药品如下:①石灰石②澄清石灰水③稀硫酸④浓硫酸⑤盐酸溶液⑥烧碱溶液⑦蒸馏水。下列装置连接顺序及组合最恰当的是( )

A. A(①⑤)、B(④)、C(⑦)、DB. A(①③)、B(④)、C(⑦)、D
C. A(①⑤)、B(⑦)、C(④)、DD. A(①⑤)、B(⑥)、C(④)、D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,将4.48L的NO2和NO组成的混合气体通入100mL的水中,气体体积缩小为2.24L,假设溶液的体积不变,则下列说法中错误的是( )
A.所得溶液中溶质的物质的量浓度为1.0mol·L-1
B.剩余气体中氮元素与氧元素的质量为7∶8
C.原混合气体中NO2和NO的体积比为1∶1
D.反应过程中转移的电子总数为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温室效应是由于大气里温室气体(二氧化碳、甲烷等)含量增大而形成的。回答下列问题:
(1)利用CO2可以制取甲醇,有关化学反应如下:
①CO2(g)+3H2(g)CH3OH(g)+H2O(g ) ΔH1=-178 kJ·mol-1
②2CO(g)+O2(g)2CO2(g) ΔH2=-566 kJ·mol-1
③2H2(g)+O2(g)2H2O(g) ΔH3=-483.6 kJ·mol-1
已知反应①中相关的化学键键能数据如下:
化学键 | C—C | C—H | H—H | C—O | H—O |
键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 463 |
由此计算断开1 mol C![]() O需要吸收____________kJ的能量。
O需要吸收____________kJ的能量。
(2)甲烷燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:通入a气体的电极是原电池的______极(填“正”或“负”),其电极反应式为______。

(3)如图是用甲烷燃料电池(电解质溶液为KOH溶液)实现铁上镀铜,则b处通入的是____(填“CH4”或“O2”),电解前,U形管的铜电极、铁电极的质量相等,电解2min后,取出铜电极、铁电极,洗净、烘干、称量,质量差为12.8g,在通电过程中,电路中通过的电子为_____mol,消耗标准状况下CH4______mL.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:

(1)反应Ⅰ:2H2SO4(l)===2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)===SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:_________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。p2___p1(填“>”或“<”),得出该结论的理由是____。

(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
ⅰ.SO2+4I-+4H+===S↓+2I2+2H2O
ⅱ.I2+2H2O+_____===_____+____+2I-
(4)探究ⅰ、ⅱ反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mLSO2饱和溶液加入2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)

①B是A的对比实验,则a=_____。
②比较A、B、C,可得出的结论是_______。
③实验表明,SO2的歧化反应速率D>A。结合ⅰ、ⅱ反应速率解释原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料。已知在25℃、101kPa下,8gN2H4(g)完全燃烧生成氮气和液态水时,放出133.5 kJ热量。则下列热化学方程中正确的是( )
A. N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1
B. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-133.5kJ·mol-1
C. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=+534kJ·mol-1
D. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
①干冰与CO2; ②白磷与红磷; ③![]() Cl与
Cl与![]() Cl;
Cl;
④液氯与氯水; ⑤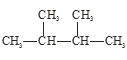 与
与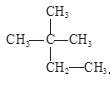 。
。
在上述各组物质中:
(1)互为同位素的是_____________;
(2)互为同素异形体的是__________,
(3)互为同分异构体的是_________;
(4)属于同种物质的是_________。(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍等金属及其化合物在科学研究和工业生产中应用十分广泛。回答下列问题:
(1)铁、钴、镍的基态原子核外未成对电子数最多的是_________。
(2)酞菁钴分子的结构简式如图所示,中心离子为钴离子,酞钴分子中与钴离子通过配位键结合的氮原子的编号是_______(填1、2、3、4),三种非金属原子的电负性由大到小的顺序为_______(用相应的元素符号表示);氮原子的杂化轨道类型为________。

(3)Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x,晶体属于_______(填晶体类型),若配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=________。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO______FeO(填“>”“<”或“=”),原因是_________。
(5)NiAs的晶胞结构如图所示:①镍离子的配位数为_________。
②若阿伏加德罗常数的值为NA,晶体密度为pg·cm-3,则该晶胞中最近的Ni2+之间的距离为________cm。(写出计算表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。关于常温下pH=2的H2C2O4溶液,下列说法正确的是( )
A. 1L溶液中的H+数目为0.02NA
B. 加入NaHC2O4固体,溶液酸性增强
C. c(H+)-c(OH-)=c(HC2O4-)+2c(C2O42-)
D. 加水稀释,溶液中所有离子浓度均减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com