
【题目】利用控制n(H2S):n(FeCl3)=1:2反应得到的产物再用电解法制氢,其工作原理如图所示。下列有关的说法错误的是( )
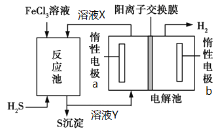
A. 惰性电极a发生氧化反应
B. Fe(OH)3胶体中滴加溶液X,先有沉淀后沉淀溶解
C. 溶液Y加热蒸发灼烧最终得到Fe2O3
D. 电解池总反应的离子方程式为2Fe2++2H+![]() 2Fe3++H2↑
2Fe3++H2↑
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】工业上常采用煅烧黄铁矿来制备SO2,同时产生烧渣。烧渣的主要成分是含铁的氧化物和二氧化硅等,利用烧渣制备高效净水剂聚合硫酸铁可以达到资源综合利用的目的。其工艺流程如下:
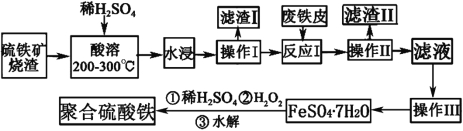
⑴检验“反应I”后的溶液中是否含有Fe3+的试剂是 。
⑵滤渣I的主要成分是 。
⑶“操作III”中具体的方法依次为 、 、过滤和洗涤。
⑷加入适量H2O2的目的是将Fe2+氧化为Fe3+,氧化时需控制反应温度为50~60℃的原因是 。
⑸生成聚合硫酸铁的过程是先水解再聚合,聚合的化学方程式为
mFe2(OH)n(SO4)( 3-![]() )
)![]() [Fe2(OH)n(SO4)( 3-
[Fe2(OH)n(SO4)( 3-![]() )]m
)]m
请写出水解的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.C3H8和C5H12不一定互为同系物
B.丙烷中三个碳原子一定不在同一条直线上
C.“西气东输”中的“气”指的是煤气
D.乙烯使溴的四氯化碳溶液褪色,反应类型为取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含32P的磷酸盐培养液培养动物细胞,一段时间后,下列细胞结构或者化合物中 均具有放射性的是
①脱氧核糖
②核膜
③DNA
④甲状腺激素
⑤腺苷
A. ①③ B. ①③⑤ C. ②③ D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下面是我们熟悉的物质:
①O2②SO2③CaCl2④HNO3⑤NaOH ⑥NH4Cl
这些物质中,属于共价化合物的是 ___________;属于离子化合物的是___________;只含离子键的是___________。
(2)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
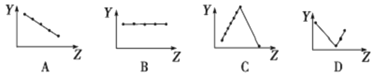
把与下面的元素有关性质相符的曲线的标号填入相应括号中:
①第ⅡA族元素的最外层电子数________________。
②第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径________________。
③第二、三周期主族元素随原子序数递增原子半径的变化____________。
(3)已知某单核粒子的结构示意图为:![]()
①当x-y=10时,该粒子为____________(填“原子”、“阳离子”或“阴离子”)。
②当y=8时,若该微粒的氧化性很弱,得一个电子后变为原子,该微粒的符号是_____________。
(4)已知A、B、C、D是中学化学中常见的四种10电子微粒,
它们之间存在如图中转化关系。
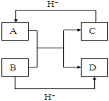
请写出:A的化学式 (写一种);D的化学式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向AgCl饱和溶液中加水,下列叙述正确的是( )
A. 结晶过程停止,溶解过程加快 B. 溶解度、Ksp均变大
C. 溶解度、Ksp均不变 D. 结晶过程将小于溶解过程,直至再达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是重要的防腐剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。 (夹持装置和A中加热装置已略,气密性已检验)。
查阅资料:①HNO2为弱酸,室温下存在反应3HNO2==HNO3+2NO↑+H2O;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
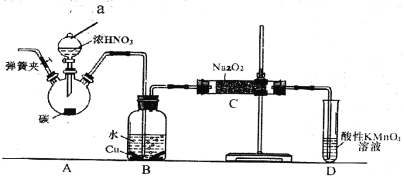
实验操作:①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
回答下列问题:
(1)装置中仪器a的名称为___________;D装置的作用是_______________。
(2)A中反应的化学方程式是___________________,C中反应生成NaNO2的化学方程式是____________。
(3)检验C中产物有亚硝酸钠的正确操作是__________
a.取少量生成物溶于水充分振荡,滴加酚酞试液,若溶液变红,则含有NaNO2。
b.取少量生成物溶于稀硫酸,若产生无色气体并在液体上方变为红棕色,则含有NaNO2。
(4)经检验C产物中亚硝酸钠含量较少。
①甲同学认为C中产物不仅有亚硝酸钠,还可能有其它固体物质。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是________(写名称).
②乙同学认为除上述干扰因素外,还会有空气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是______________。
(5)NaNO2有毒,国家规定肉制品中NaNO2含量不能超过30mg/kg。从1000g隔夜熟肉, 中提取NaNO3和NaNO2后,配成溶液,再用0.00500mol/L的高锰酸钾(酸性)溶液滴定,消耗高锰酸钾溶液16.00mL,由此计算隔夜熟肉中NaNO2的含量是________mg/kg 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com