
【题目】亚硝酸钠是重要的防腐剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。 (夹持装置和A中加热装置已略,气密性已检验)。
查阅资料:①HNO2为弱酸,室温下存在反应3HNO2==HNO3+2NO↑+H2O;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
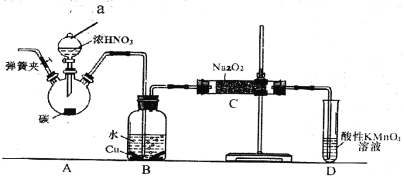
实验操作:①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
回答下列问题:
(1)装置中仪器a的名称为___________;D装置的作用是_______________。
(2)A中反应的化学方程式是___________________,C中反应生成NaNO2的化学方程式是____________。
(3)检验C中产物有亚硝酸钠的正确操作是__________
a.取少量生成物溶于水充分振荡,滴加酚酞试液,若溶液变红,则含有NaNO2。
b.取少量生成物溶于稀硫酸,若产生无色气体并在液体上方变为红棕色,则含有NaNO2。
(4)经检验C产物中亚硝酸钠含量较少。
①甲同学认为C中产物不仅有亚硝酸钠,还可能有其它固体物质。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是________(写名称).
②乙同学认为除上述干扰因素外,还会有空气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是______________。
(5)NaNO2有毒,国家规定肉制品中NaNO2含量不能超过30mg/kg。从1000g隔夜熟肉, 中提取NaNO3和NaNO2后,配成溶液,再用0.00500mol/L的高锰酸钾(酸性)溶液滴定,消耗高锰酸钾溶液16.00mL,由此计算隔夜熟肉中NaNO2的含量是________mg/kg 。
【答案】
(1)分液漏斗;除去未反应的NO,防止污染空气;
(2)C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;2NO+Na2O2=2NaNO2;
CO2↑+4NO2↑+2H2O;2NO+Na2O2=2NaNO2;
(3)b;
(4)①碱石灰;②打开弹簧夹,通入N2一段时间;
(5)13.8。
【解析】
试题分析:(1)根据装置图可知仪器a的名称为分液漏斗,实验中的尾气NO,会污染空气,所以D装置的作用是除去未反应的NO,防止污染空气,故答案为:分液漏斗;除去未反应的NO,防止污染空气;
(2)装置A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,反应方程式为C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O,过氧化钠与NO反应会生成NaNO2,反应的化学方程为2NO+Na2O2=2NaNO2,故答案为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,过氧化钠与NO反应会生成NaNO2,反应的化学方程为2NO+Na2O2=2NaNO2,故答案为:C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;2NO+Na2O2=2NaNO2;
CO2↑+4NO2↑+2H2O;2NO+Na2O2=2NaNO2;
(3)检验亚硝酸钠的实验设计为将生成物置于试管中,加入稀硫酸,若产生无色气体并在液面上方变为红棕色,则D中产物是亚硝酸钠,或将生成物置于试管中,加入酸性KMnO4溶液,若溶液紫色褪去,则D中产物是亚硝酸钠,故选b;
(4)①为排除干扰在B、C装置间增加装置E,E中盛放的试剂应碱石灰,用来吸收二氧化碳;故答案为:碱石灰;
②为避免装置中的空气导致产品不纯,需要打开弹簧夹通入氮气排净装置中的空气,故答案为:打开弹簧夹,通入N2一段时间;
(5)依据电子得失守恒可知,亚硝酸钠与高锰酸钾(酸性)溶液发生氧化还原反应的关系式为5NaNO2~2KMnO4,可计算出1000g隔夜熟肉中NaNO2的质量为2.5×0.00500mol/L×16.00mL×10-3×69=13.8mg,所以隔夜熟肉中NaNO2的含量为13.8mg/kg,故答案为:13.8。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】利用控制n(H2S):n(FeCl3)=1:2反应得到的产物再用电解法制氢,其工作原理如图所示。下列有关的说法错误的是( )
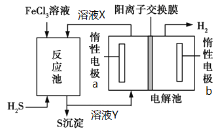
A. 惰性电极a发生氧化反应
B. Fe(OH)3胶体中滴加溶液X,先有沉淀后沉淀溶解
C. 溶液Y加热蒸发灼烧最终得到Fe2O3
D. 电解池总反应的离子方程式为2Fe2++2H+![]() 2Fe3++H2↑
2Fe3++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧
C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1 mol/L HCl溶液滴定10 mL 0.1 mol/L Na2CO3溶液,滴定曲线如图所示。下列说法正确的是
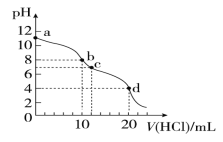
A.a点时:c(Na+)>c(CO32-)>c (HCO3-)>c(OH-)
B.b点时:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
C.水电离程度由大到小的顺序为:a>b>c>d
D.d点时:c(H+)>c(HCO3-)=c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】健康是人生的主题。下列与人体健康有关的叙述正确的是( )
①喝牛奶、豆浆等富含蛋白质的食品可有效缓解煤气中毒
②人体胃液的pH为0.9~1.5
③人体摄入过量的氟元素可导致龋齿
④人体中的酶都是在体温和中性条件下进行催化的
A.①②③④ B.②③④ C.②④ D.②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按如图所示的装置进行试验.A、B为两种常见金属,它们的硫酸盐可溶于水.当K闭合时,在交换膜处SO42﹣从右向左移动.下列分析正确的是( )
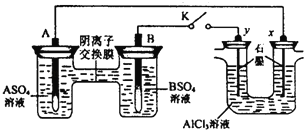
A.溶液中c(A2+)浓度减小
B.B的电极反应:B﹣2e﹣═B2+
C.y电极上有H2产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
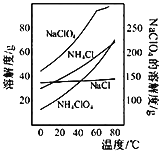
【题目】高氯酸铵可用于火箭推进剂,实验室可由NaClO等原料制取(部分物质溶解度如下图),其实验流程如下:
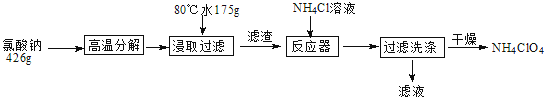
(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为_____________________。
(2)80℃时浸取液冷却至0℃过滤,滤渣的主要成分为_________________(写化学式)。
(3)反应器中加入氯化铵饱和溶液发生反应的离子方程式为_____________________
(4)已知:2NH4C1O4![]() N2+2O2↑+C12↑+4H2O,现可提供下列试剂:
N2+2O2↑+C12↑+4H2O,现可提供下列试剂:
a.饱和食盐水 b.浓H2SO4 c.NaOH溶液 d.CuO e.Cu
利用下图装置对高氯酸铵热分解产生的三种气体进行分别吸收或收集。
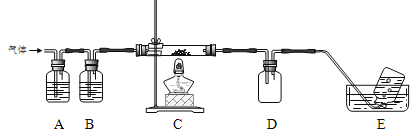
①E中收集到的气体可能是__________(填化学式)。
②A、B、C中盛放的药品依次可以是_________(选填:I、II、III)。
I.a、b、d II.c、b、d III.c、b、e
(5)过滤用到的主要玻璃仪器是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物有广泛的用途。
(1)反应C(s)+H2O(g)![]() CO(g)+H2(g)ΔH=+131.3kJmol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
CO(g)+H2(g)ΔH=+131.3kJmol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
A.增加碳的用量 B.升高温度 C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+CO2(g)![]() 2CO(g)△H=+172.5kJmol-1
2CO(g)△H=+172.5kJmol-1
则反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的△H= kJmol-1。
CO2(g)+H2(g)的△H= kJmol-1。
(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为 。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
t / min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
①其它条件不变,降低温度,达到新平衡前v(逆)__________v(正)(填“>”、“<”或“=”) 。
②该温度下,此反应的平衡常数K= ;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数______(填“增大”、 “减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、NH![]() 、CO
、CO![]() 、SO
、SO![]() 、SO
、SO![]() 、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
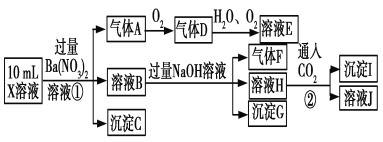
下列说法正确的是
A.气体A是NO2
B.X中肯定存在Fe2+、Al3+、NH![]() 、SO
、SO![]()
C.溶液E和气体F不能发生化学反应
D.X中不能确定的离子是Al3+和Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com