
【题目】某同学按如图所示的装置进行试验.A、B为两种常见金属,它们的硫酸盐可溶于水.当K闭合时,在交换膜处SO42﹣从右向左移动.下列分析正确的是( )
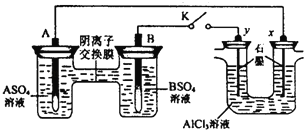
A.溶液中c(A2+)浓度减小
B.B的电极反应:B﹣2e﹣═B2+
C.y电极上有H2产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】(1)下面是我们熟悉的物质:
①O2②SO2③CaCl2④HNO3⑤NaOH ⑥NH4Cl
这些物质中,属于共价化合物的是 ___________;属于离子化合物的是___________;只含离子键的是___________。
(2)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
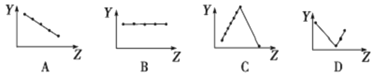
把与下面的元素有关性质相符的曲线的标号填入相应括号中:
①第ⅡA族元素的最外层电子数________________。
②第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径________________。
③第二、三周期主族元素随原子序数递增原子半径的变化____________。
(3)已知某单核粒子的结构示意图为:![]()
①当x-y=10时,该粒子为____________(填“原子”、“阳离子”或“阴离子”)。
②当y=8时,若该微粒的氧化性很弱,得一个电子后变为原子,该微粒的符号是_____________。
(4)已知A、B、C、D是中学化学中常见的四种10电子微粒,
它们之间存在如图中转化关系。
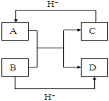
请写出:A的化学式 (写一种);D的化学式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个容积相同的容器中,一个盛有NH3,另一个盛有N2、H2的混合气体,在同温同压下,两容器内的气体一定具有相同的
A. 原子数 B. 分子数 C. 质量 D. 密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物能使澳的CC4溶液褪色,也能在一定条件下发生水解生成两种有机物,还能发生加聚反应生成高分子化合物,则此有机物中通常含有的基团的组合是
A. 卤素原子、碳碳双键 B. 羟基、羧基 C. 醛基、酯基 D. 碳碳双键、酯基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是重要的防腐剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。 (夹持装置和A中加热装置已略,气密性已检验)。
查阅资料:①HNO2为弱酸,室温下存在反应3HNO2==HNO3+2NO↑+H2O;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
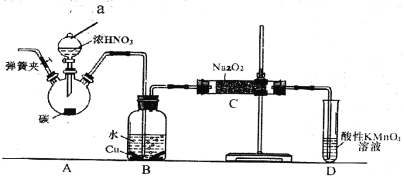
实验操作:①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
回答下列问题:
(1)装置中仪器a的名称为___________;D装置的作用是_______________。
(2)A中反应的化学方程式是___________________,C中反应生成NaNO2的化学方程式是____________。
(3)检验C中产物有亚硝酸钠的正确操作是__________
a.取少量生成物溶于水充分振荡,滴加酚酞试液,若溶液变红,则含有NaNO2。
b.取少量生成物溶于稀硫酸,若产生无色气体并在液体上方变为红棕色,则含有NaNO2。
(4)经检验C产物中亚硝酸钠含量较少。
①甲同学认为C中产物不仅有亚硝酸钠,还可能有其它固体物质。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是________(写名称).
②乙同学认为除上述干扰因素外,还会有空气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是______________。
(5)NaNO2有毒,国家规定肉制品中NaNO2含量不能超过30mg/kg。从1000g隔夜熟肉, 中提取NaNO3和NaNO2后,配成溶液,再用0.00500mol/L的高锰酸钾(酸性)溶液滴定,消耗高锰酸钾溶液16.00mL,由此计算隔夜熟肉中NaNO2的含量是________mg/kg 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1 mol CO2和3 molH2,一定条件下发生反应:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
T温度下,测得CO2和CH3OH(g)的浓度随时间变化如下图。请回答下列问题:

① 达平衡时,氢气的平衡浓度为C (H2)= 。
② 能够说明该反应已达到平衡的是 (填字母序号,下同)。
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO、H2和CH3OH的浓度保持不变
D.一定条件下,单位时间内消耗3 mol H2的同时生成1 mol CH3OH
③ 下列措施中能使平衡混合物中![]() 增大的是______________。
增大的是______________。
A.加入催化剂 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.降低温度
④ 求此温度(T)下该反应的平衡常数K = 。若开始时向该1 L密闭容器中充入1 mol CO2,2molH2,1.5mol CH3OH和1 mol H2O(g),则反应向 (填“正”或“逆”)反应方向进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,属于吸热反应的是( )
①液态水汽化; ②胆矾加热变为白色粉末;③浓硫酸稀释;
④氯酸钾分解制氧气;⑤碳与氧气反应生成一氧化碳。
A.①③⑤ B.②④ C.①② D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式: .若1g水蒸气转化成液态水放热2.5kJ,则氢气的燃烧热为△H= kJ/mol.
(2)近年来已经研制出甲烷(CH4)燃料电池,该电池的电解质溶液为H2SO4溶液,写出该电池负极的电极反应式: .该电池总反应式: .
(3)用惰性电极电解AgNO3溶液,写出该电解反应的化学方程式 ;若在阳极收集到 0.32g O2,中和电解生成的酸需0.4molL﹣1NaOH溶液 mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题。
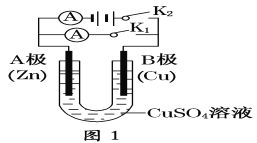

(1)根据图1回答:
①若断开K1,闭合K2,A电极可观察到的现象是________________;B极的电极反应式为___________________。
②若断开K2,闭合K1。
A电极可观察到的现象_________________________;
B极的电极反应式为__________________________。
(2)根据图2回答:
①将较纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为________________,电解反应的离子方程式为_________________。
②实验完成后,铜电极增重128 g,石墨电极产生标准状况下的气体体积________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com