
ЎѕМвДїЎїЈЁ1Ј©УЙЗвЖшєНСхЖш·ґУ¦ЙъіЙ1molЛ®ХфЖш·ЕИИ241.8kJЈ¬РґіцёГ·ґУ¦µДИИ»ЇС§·ЅіМКЅЈє Ј®Иф1gЛ®ХфЖшЧЄ»ЇіЙТєМ¬Л®·ЕИИ2.5kJЈ¬ФтЗвЖшµДИјЙХИИОЄЎчH= kJ/molЈ®
ЈЁ2Ј©ЅьДкАґТСѕСРЦЖіцјЧНйЈЁCH4Ј©ИјБПµзіШЈ¬ёГµзіШµДµзЅвЦКИЬТєОЄH2SO4ИЬТєЈ¬РґіцёГµзіШёєј«µДµзј«·ґУ¦КЅЈє Ј®ёГµзіШЧЬ·ґУ¦КЅЈє Ј®
ЈЁ3Ј©УГ¶иРФµзј«µзЅвAgNO3ИЬТєЈ¬РґіцёГµзЅв·ґУ¦µД»ЇС§·ЅіМКЅ Ј»ИфФЪСфј«КХјЇµЅ 0.32g O2Ј¬ЦРєНµзЅвЙъіЙµДЛбРи0.4molL©Ѓ1NaOHИЬТє mLЈ®
Ўѕґр°ёЎїЈЁ1Ј©H2ЈЁgЈ©+![]() O2ЈЁgЈ©=H2OЈЁgЈ©ЎчH=©Ѓ241.8kJ/molЈ¬H=©Ѓ285.8 kJ/molЈ®
O2ЈЁgЈ©=H2OЈЁgЈ©ЎчH=©Ѓ241.8kJ/molЈ¬H=©Ѓ285.8 kJ/molЈ®
ЈЁ2Ј©CH4©Ѓ8e©Ѓ+2H2O=CO2+8H+Ј¬CH4+2O2=CO2+2H2O Ј®
ЈЁ3Ј©4AgNO3+2H2O![]() 4Ag+4HNO3+O2ЎьЈ»100 mLЈ®
4Ag+4HNO3+O2ЎьЈ»100 mLЈ®
ЎѕЅвОцЎї
КФМв·ЦОцЈєЈЁ1Ј©ЗвЖшєНСхЖш·ґУ¦ЙъіЙ1molЛ®ХфЖш·ЕИИ241.8kJЈ¬ёГ·ґУ¦µДИИ»ЇС§·ЅіМКЅОЄH2ЈЁgЈ©+![]() O2ЈЁgЈ©=H2OЈЁgЈ©ЎчH=©Ѓ241.8kJ/molЈ¬ИјЙХИИКЗЦёФЪ298KЎў101kPaК±Ј¬1molїЙИјОпНкИ«ИјЙХЙъіЙОИ¶ЁµДСх»ЇОпК±µД·ґУ¦ИИЈ¬Л®µДЧґМ¬У¦ОЄТєМ¬Ј¬Иф1gЛ®ХфЖшЧЄ»ЇіЙТєМ¬Л®·ЕИИ2.5kJЈ¬Фт1molЛ®ХфЖшЧЄ»ЇіЙТєМ¬Л®·ЕИИЈЁ2.5ЎБ18Ј©kJ=44kJЈ¬ФтЗвЖшµДИјЙХИИОЄЎчH=©Ѓ285.8 kJ/molЎЈ
O2ЈЁgЈ©=H2OЈЁgЈ©ЎчH=©Ѓ241.8kJ/molЈ¬ИјЙХИИКЗЦёФЪ298KЎў101kPaК±Ј¬1molїЙИјОпНкИ«ИјЙХЙъіЙОИ¶ЁµДСх»ЇОпК±µД·ґУ¦ИИЈ¬Л®µДЧґМ¬У¦ОЄТєМ¬Ј¬Иф1gЛ®ХфЖшЧЄ»ЇіЙТєМ¬Л®·ЕИИ2.5kJЈ¬Фт1molЛ®ХфЖшЧЄ»ЇіЙТєМ¬Л®·ЕИИЈЁ2.5ЎБ18Ј©kJ=44kJЈ¬ФтЗвЖшµДИјЙХИИОЄЎчH=©Ѓ285.8 kJ/molЎЈ
ЈЁ2Ј©јЧНйЈЁCH4Ј©ИјБПµзіШЈ¬µзЅвЦКИЬТєОЄH2SO4ИЬТєЈ¬јЧНй·ўЙъСх»Ї·ґУ¦Ј¬ФЪИјБПµзіШµДёєј«·ўЙъ·ґУ¦ЙъіЙ¶юСх»ЇМјЈ¬µзј«·ґУ¦КЅОЄCH4©Ѓ8e©Ѓ+2H2O=CO2+8H+Ј¬ёГµзіШЧЬ·ґУ¦КЅОЄCH4+2O2=CO2+2H2OЎЈ
ЈЁ3Ј©УГ¶иРФµзј«µзЅвAgNO3ИЬТєЈ¬Тхј«ЙПТшАлЧУ·ўЙъ»№Ф·ґУ¦ЙъіЙµҐЦКТшЈ¬Сфј«ЙПЗвСхёщ·ўЙъ»№Ф·ґУ¦ЙъіЙСхЖшєНПхЛбЈ¬ёГµзЅв·ґУ¦µД»ЇС§·ЅіМКЅОЄ4AgNO3 + 2H2O ![]() 4Ag + 4HNO3 + O2ЎьЈ»ИфФЪСфј«КХјЇµЅ 0.32g O2Ј¬ФтЙъіЙПхЛбµДОпЦКµДБїОЄ0.04molЈ¬ЦРєНПхЛбЛщРиЗвСх»ЇДЖµДОпЦКµДБїОЄ0.04molЈ¬Ри0.4molL©Ѓ1NaOHИЬТє100 mLЎЈ
4Ag + 4HNO3 + O2ЎьЈ»ИфФЪСфј«КХјЇµЅ 0.32g O2Ј¬ФтЙъіЙПхЛбµДОпЦКµДБїОЄ0.04molЈ¬ЦРєНПхЛбЛщРиЗвСх»ЇДЖµДОпЦКµДБїОЄ0.04molЈ¬Ри0.4molL©Ѓ1NaOHИЬТє100 mLЎЈ



| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїµЄ»ЇВБЈЁAlNЈ©КЗТ»ЦЦРВРНОЮ»ъ·ЗЅрКфІДБПЎЈДіAlNСщЖ·Ѕцє¬УРAl2O3ФУЦКЈ¬ОЄІв¶ЁAlNµДє¬БїЈ¬ЙијЖИзПВИэЦЦКµСй·Ѕ°ёЎЈ
ТСЦЄЈєAlN+NaOH+H2OЈЅNaAlO2+NH3Ўь
Ўѕ·Ѕ°ё1ЎїИЎТ»¶ЁБїµДСщЖ·Ј¬УГТФПВЧ°ЦГІв¶ЁСщЖ·ЦРAlNµДґї¶ИЈЁјРіЦЧ°ЦГТСВФИҐЈ©ЎЈ
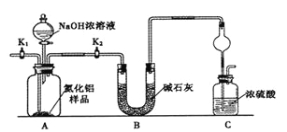
ЈЁ1Ј©ЙПНјCЧ°ЦГЦРЗтРОёЙФп№ЬµДЧчУГКЗ ЎЈ
ЈЁ2Ј©НкіЙТФПВКµСйІЅЦиЈєЧйЧ°єГКµСйЧ°ЦГЈ¬КЧПИ Ј¬ФЩјУИлКµСйТ©Ж·ЎЈЅУПВАґµДКµСйІЩЧчКЗ Ј¬ґтїЄ·ЦТєВ©¶·»оИыЈ¬јУИлNaOHЕЁИЬТєЈ¬ЦБІ»ФЩІъЙъЖшМеЎЈґтїЄK1Ј¬НЁИлµЄЖшТ»¶ОК±јдЈ¬Ів¶ЁCЧ°ЦГ·ґУ¦З°єуµДЦКБї±д»ЇЎЈ
ЈЁ3Ј©УЙУЪЧ°ЦГґжФЪИ±ПЭЈ¬µјЦВІв¶ЁЅб№ыЖ«ёЯЈ¬ЗлМбіцёДЅшТвјы
Ўѕ·Ѕ°ё2ЎїУГУТНјЧ°ЦГІв¶Ёm gСщЖ·ЦРA1NµДґї¶ИЈЁІї·ЦјРіЦЧ°ЦГТСВФИҐЈ©ЎЈ
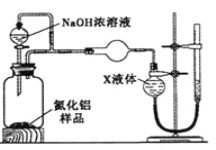
ЈЁ4Ј©ОЄІв¶ЁЙъіЙЖшМеµДМе»эЈ¬БїЖшЧ°ЦГЦРµДXТєМеїЙТФКЗ ЎЈ
aЈ®CCl4 bЈ®H2O
c.NH4ClИЬТє dЈ®±Ѕ
ЈЁ5Ј©Ифm gСщЖ·НкИ«·ґУ¦Ј¬ІвµГЙъіЙЖшМеµДМе»эОЄV mLЈЁТСЧЄ»»ОЄ±кЧјЧґїцЈ©Ј¬ФтAINµДЦКБї·ЦКэКЗ ЎЈ
Ўѕ·Ѕ°ё3Ўї°ґТФПВІЅЦиІв¶ЁСщЖ·ЦРA1NµДґї¶ИЈє
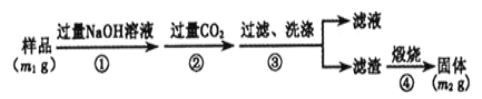
ЈЁ6Ј©ІЅЦиўЪЙъіЙіБµнµДАлЧУ·ЅіМКЅОЄ ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїДіН¬С§°ґИзНјЛщКѕµДЧ°ЦГЅшРРКФСйЈ®AЎўBОЄБЅЦЦіЈјыЅрКфЈ¬ЛьГЗµДБтЛбСОїЙИЬУЪЛ®Ј®µ±K±ХєПК±Ј¬ФЪЅ»»»Д¤ґ¦SO42©ЃґУУТПтЧуТЖ¶ЇЈ®ПВБР·ЦОцХэИ·µДКЗЈЁ Ј©
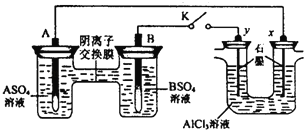
AЈ®ИЬТєЦРcЈЁA2+Ј©ЕЁ¶ИјхРЎ
BЈ®BµДµзј«·ґУ¦ЈєB©Ѓ2e©ЃЁTB2+
CЈ®yµзј«ЙПУРH2ІъЙъЈ¬·ўЙъ»№Ф·ґУ¦
DЈ®·ґУ¦іхЖЪЈ¬xµзј«ЦЬО§іцПЦ°ЧЙ«ЅєЧґіБµнЈ¬І»ѕГіБµнИЬЅв
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїMnO2КЗТ»ЦЦЦШТЄµДОЮ»ъ№¦ДЬІДБПЈ¬№¤ТµЙПґУГМЅбєЛЦРЦЖИЎґїѕ»µДMnO2№¤ТХБчіМИзПВНјЛщКѕЈє

Ії·ЦДСИЬµДµзЅвЦКИЬ¶И»эіЈКэ(Ksp)ИзПВ±нЈє
»ЇєПОп | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
KspЅьЛЖЦµ | 10©Ѓ17 | 10©Ѓ17 | 10©Ѓ39 |
ТСЦЄЈєТ»¶ЁМхјюПВЈ¬MnO4![]() їЙУлMn2+·ґУ¦ЙъіЙMnO2
їЙУлMn2+·ґУ¦ЙъіЙMnO2
ЈЁ1Ј©ІЅЦиўтЦРПыєД0. 5molMn2+К±Ј¬УГИҐ1molL-1µДNaClO3ИЬТє200mlЈ¬ёГ·ґУ¦АлЧУ·ЅіМКЅОЄ
ЈЁ2Ј©ТСЦЄИЬТєBµДИЬЦКЦ®Т»їЙС»·УГУЪЙПКцЙъІъЈ¬ґЛОпЦКµДГыіЖКЗ_____________ЎЈ
ЈЁ3Ј©MnO2КЗјоРФРїГМµзіШµДХэј«ІДБПЈ®·Еµз№эіМІъЙъMnOOHЈ¬ёГµзіШХэј«µДµзј«·ґУ¦КЅКЗ ЎЈИз№ыО¬іЦµзБчЗї¶ИОЄ5AЈ¬µзіШ№¤ЧчОе·ЦЦУЈ¬АнВЫПыєДРї gЈ®ЈЁТСЦЄF=96500C/molЈ©
ЈЁ4Ј©Пт·ПѕЙРїГМµзіШДЪµД»мєПОпЈЁЦчТЄіЙ·ЦMnOOHЎўZn(OH)2Ј©ЦРјУИлТ»¶ЁБїµДПЎБтЛбєНПЎІЭЛбЈЁH2C2O4Ј©Ј¬ІўІ»¶ПЅБ°иЦБОЮCO2ІъЙъОЄЦ№Ј¬РґіцMnOOHІОУл·ґУ¦µДАлЧУ·ЅіМКЅ ЎЈ
ЎЈПтЛщµГИЬТєЦРµОјУёЯГМЛбјШИЬТєІъЙъєЪЙ«іБµнЈ¬ЙијЖКµСйЦ¤ГчєЪЙ«іБµніЙ·ЦОЄMnO2 ЎЈ
ЈЁ5Ј©УГ·ПµзіШµДРїЖ¤ЦЖЧчZnSO47H2OµД№эіМЦРЈ¬РиіэИҐРїЖ¤ЦРµДЙЩБїФУЦКМъЈ¬Жд·Ѕ·ЁКЗЈєјУИлПЎH2SO4єНH2O2Ј¬МъИЬЅв±дОЄFe3+Ј¬јУјоµчЅЪpHОЄ К±Ј¬МъёХєГіБµнНкИ«ЈЁАлЧУЕЁ¶ИРЎУЪ1ЎБ10©Ѓ5molL©Ѓ1К±Ј¬јґїЙИПОЄёГАлЧУіБµнНкИ«Ј©ЎЈјМРшјУјоµчЅЪpHОЄ К±Ј¬РїїЄКјіБµнЈЁјЩ¶ЁZn2+ЕЁ¶ИОЄ0.1molL©Ѓ1Ј©ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїМјј°Жд»ЇєПОпУР№г·єµДУГНѕЎЈ
ЈЁ1Ј©·ґУ¦C(s)Ј«H2O(g)![]() CO(g)Ј«H2(g)¦¤H=+131.3kJmol-1Ј¬ґпµЅЖЅєвєуЈ¬Ме»эІ»±дК±Ј¬ТФПВУРАыУЪМбёЯH2ІъВКµДґлК©КЗ ЎЈ
CO(g)Ј«H2(g)¦¤H=+131.3kJmol-1Ј¬ґпµЅЖЅєвєуЈ¬Ме»эІ»±дК±Ј¬ТФПВУРАыУЪМбёЯH2ІъВКµДґлК©КЗ ЎЈ
AЈ®ФцјУМјµДУГБї BЈ®ЙэёЯОВ¶И CЈ®УГCOОьКХјБіэИҐCO DЈ®јУИлґЯ»ЇјБ
ЈЁ2Ј©ТСЦЄЈ¬CЈЁsЈ©+CO2ЈЁgЈ©![]() 2COЈЁgЈ©ЎчH=+172.5kJmol-1
2COЈЁgЈ©ЎчH=+172.5kJmol-1
Фт·ґУ¦COЈЁgЈ©+H2OЈЁgЈ©![]() CO2ЈЁgЈ©+H2ЈЁgЈ©µДЎчH= kJmol-1ЎЈ
CO2ЈЁgЈ©+H2ЈЁgЈ©µДЎчH= kJmol-1ЎЈ
ЈЁ3Ј©COУлH2Т»¶ЁМхјюПВ·ґУ¦ЙъіЙјЧґјЈЁCH3OHЈ©Ј¬јЧґјКЗТ»ЦЦИјБПЈ¬їЙАыУГјЧґјЙијЖТ»ёцИјБПµзіШЈ¬УГПЎБтЛбЧчµзЅвЦКИЬТєЈ¬¶аїЧКЇД«Чцµзј«Ј¬ёГµзіШёєј«·ґУ¦КЅОЄ ЎЈ
ЈЁ4Ј©ФЪТ»¶ЁОВ¶ИПВЈ¬Ѕ«CO(g)єНH2O(g)ёч0.16 mol·Ц±рНЁИлµЅМе»эОЄ2.0LµДєгИЭГЬ±ХИЭЖчЦРЈ¬·ўЙъТФПВ·ґУ¦ЈєCO(g)Ј«H2O(g) ![]() CO2(g)Ј«H2(g)Ј¬µГµЅИзПВКэѕЭЈє
CO2(g)Ј«H2(g)Ј¬µГµЅИзПВКэѕЭЈє
t / min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
ўЩЖдЛьМхјюІ»±дЈ¬ЅµµНОВ¶ИЈ¬ґпµЅРВЖЅєвЗ°v(Дж)__________v(Хэ)(МоЎ°>Ў±ЎўЎ°<Ў±»тЎ°=Ў±) ЎЈ
ўЪёГОВ¶ИПВЈ¬ґЛ·ґУ¦µДЖЅєвіЈКэK= Ј»
ўЫЖдЛьМхјюІ»±дЈ¬ФЩідИл0.1mol COєН0.1mol H2O(g)Ј¬ЖЅєвК±COµДМе»э·ЦКэ______(МоЎ°ФцґуЎ±Ўў Ў°јхРЎЎ±»тЎ°І»±дЎ±)ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПВБРЛµ·ЁХэИ·µДКЗ
A. КЯІЛЛ®№ы¶аКфУЪјоРФКіОпЈ¬¶ФИЛМеЅЎїµУРТж
B. ГЮ»ЁЎўєПіЙПрЅє¶јКфУЪєПіЙІДБП
C. ІПЛїЎўСтГ«НкИ«ИјЙХЦ»ЙъіЙCO2єНH2O
D. ±ЅЎўЦІОпУНѕщДЬК№ЛбРФKMnO4ИЬТєНКЙ«
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїУГ¶иРФµзј«µзЅвОпЦКµДБїЕЁ¶ИПаН¬ЎўМе»э±ИОЄ1ЎГ2µДCuSO4єНNaClµД»мєПИЬТєЈ¬їЙДЬ·ўЙъµД·ґУ¦УР( )
ўЩ2Cu2Ј«Ј«2H2O![]() 2CuЈ«4HЈ«Ј«O2Ўь
2CuЈ«4HЈ«Ј«O2Ўь
ўЪCu2Ј«Ј«2ClЈ![]() CuЈ«Cl2Ўь
CuЈ«Cl2Ўь
ўЫ2ClЈЈ«2HЈ«![]() H2ЎьЈ«Cl2Ўь
H2ЎьЈ«Cl2Ўь
ўЬ2H2O![]() 2H2ЎьЈ«O2Ўь
2H2ЎьЈ«O2Ўь
AЈ®ўЩўЪўЫ BЈ®ўЩўЪўЬ CЈ®ўЪўЫўЬ DЈ®ўЪўЬ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїјЧЛбХэ¶ЎхҐКЗЦШТЄµДУР»ъФБПЈ¬їЙНЁ№эхҐ»Ї·ґУ¦ЦЖµГЎЈТСЦЄAµДєЛґЕ№ІХсЗвЖЧОьКХ·еµДёЯ¶И±ИОЄ3:2:2:1Ј¬±ыП©ФЪНЁіЈМхјюПВОИ¶ЁЈ¬µ«УцЗїСх»ЇјБК±ИЭТЧ±»Сх»ЇЙъіЙCO2ЎЈ
ўсЈ®Хэ¶ЎґјЈЁCH3CH2CH2CH2OHЈ©µДЦЖ±ёЎЈ
ДіСРѕїРФС§П°РЎЧйОЄєПіЙХэ¶ЎґјЈ¬ІйФДЧКБПµГЦЄТ»МхєПіЙВ·ПЯЈє
CH3CH=CH2Ј«COЈ«H2![]() AЈЁТєМ¬Ј©
AЈЁТєМ¬Ј© Хэ¶ЎґјЈ»
Хэ¶ЎґјЈ»
ЈЁ1Ј©ТСЦЄ·ґУ¦1µДФЧУАнВЫАыУГВКОЄ100%Ј¬ЗлРґіцAµДЅб№№јтКЅ ЎЈ
ЈЁ2Ј©ЦЖ±ыП©К±Ј¬»№ІъЙъЙЩБїSO2ЎўCO2ј°Л®ХфЖшЈ¬ёГРЎЧйУГТФПВКФјБјмСйХвЛДЦЦЖшМеЈ¬»мєПЖшМеНЁ№эКФјБµДЛіРтКЗ (МоРтєЕЈ¬КФјБїЙТФЦШёґК№УГ)ЎЈ
ўЩ±ҐєНNa2SO3ИЬТє ўЪЛбРФKMnO4ИЬТє
ўЫКЇ»ТЛ® ўЬОЮЛ®CuSO4 ўЭЖ·ємИЬТє
ўтЈ®јЧЛбХэ¶ЎхҐµДєПіЙЎЈ
ДіСРѕїРФС§П°РЎЧйАыУГИзНјЧ°ЦГЅшТ»ІЅєПіЙјЧЛбХэ¶ЎхҐЎЈ

ЈЁ3Ј©ґуКФ№ЬЦРИЬТєµДЧчУГіэБЛИЬЅвХэ¶ЎґјНвЈ¬»№УР ЎЈ
ЈЁ4Ј©ИфґуКФ№ЬЦРИЬТєКЗNaOHИЬТєЈ¬ФтКХјЇµЅµДІъОп±ИФ¤ЖЪµДЙЩЈ¬ЖдФТтКЗ ЎЈ
ЈЁ5Ј©ТСЦЄ·ґУ¦ЅбКшєуЙХЖїЦРКЗјЧЛбЎўХэ¶ЎґјЎўјЧЛбХэ¶ЎхҐєНБтЛбµД»мєПОпЈ¬ОЄБЛ»ШКХґуБїОґ·ґУ¦µДјЧ ЛбєНХэ¶ЎґјЈ¬ёГСРѕїРФРЎЧйёщѕЭПа№ШАн»ЇРФЦКЙијЖТФПВ·ЦАлІЩЧчІЅЦиБчіМНјЎЈ
јЧЛб | Хэ¶Ўґј | јЧЛбХэ¶ЎхҐ | |
ИЫµг/Ўж | 8.4 | -88.9 | -91 |
·Рµг/Ўж | 100.8 | 117.7 | 107 |
ИЬЅвРФ | ИэХЯДЬП໥ИЬЅвЎЈ | ||
ЙПКцБчіМНјЦРЈ¬ІЩЧч1КЗ Ј¬КФјБbКЗ ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїДіРЈ»ЇС§РЛИ¤РЎЧйМЅѕїSO2УлFeCl3ИЬТєµД·ґУ¦Ј¬ЛщУГЧ°ЦГИзНјЛщКѕЎЈ

(1)ёГРЎЧйН¬С§Ф¤ІвSO2УлFeCl3ИЬТє·ґУ¦µДПЦПуОЄИЬТєУЙЧШ»ЖЙ«±діЙЗіВМЙ«Ј¬И»єуїЄКјКµСйЎЈ
ІЅЦиўЩ | ЕдЦЖ1 molЎ¤LЈ1 FeCl3ИЬТє(ОґУГСОЛбЛб»Ї)Ј¬ІвЖдpHФјОЄ1Ј¬ИЎЙЩБїЧ°ИлКФ№ЬBЦРЈ¬јУИИA |
FeCl3ИЬТєПФЛбРФµДФТтКЗ_______________________(УГАлЧУ·ЅіМКЅ±нКѕ)ЎЈРґіцЧ°ЦГAЦРІъЙъSO2µД»ЇС§·ЅіМКЅЈє______________________ЎЈ
ЈЁ2Ј©µ±SO2НЁИлµЅFeCl3ИЬТєЦБ±ҐєНК±Ј¬Н¬С§ГЗ№ЫІмµЅµДПЦПуКЗИЬТєУЙЧШ»ЖЙ«±діЙємЧШЙ«Ј¬Г»УР№ЫІмµЅ¶Ўґп¶ыР§У¦ЎЈЅ«»мєПТє·ЕЦГ12РЎК±Ј¬ИЬТєІЕ±діЙЗіВМЙ«ЎЈ
ЎѕЧКБПЎї[Fe(HSO3)]2Ј«АлЧУОЄємЧШЙ«Ј¬ЛьїЙТФЅ«Fe3Ј«»№ФОЄFe2Ј«ЎЈЙъіЙ[Fe(HSO3)]2Ј«АлЧУµД·ґУ¦ОЄїЙДж·ґУ¦ЎЈ
ЅвКНSO2УлFeCl3ИЬТє·ґУ¦ЙъіЙємЧШЙ«[Fe(HSO3)]2Ј«µДФТтЈє_____________________ЎЈ
РґіцИЬТєЦР[Fe(HSO3)]2Ј«АлЧУУлFe3Ј«·ґУ¦µДАлЧУ·ЅіМКЅЈє_________________ЎЈ
(3)ОЄБЛМЅѕїИзєОЛх¶МємЧШЙ«±дОЄЗіВМЙ«µДК±јдЈ¬ёГРЎЧйН¬С§ЅшРРБЛІЅЦиўЪўЫµДКµСйЎЈ
ІЅЦиўЪ | Нщ5 mL 1 molЎ¤LЈ1 FeCl3ИЬТєЦРНЁИлSO2ЖшМеЈ¬ИЬТєБўјґ±дОЄємЧШЙ«ЎЈОўИИ3 minЈ¬ИЬТєСХЙ«±дОЄЗіВМЙ« |
ІЅЦиўЫ | Нщ5 mLЦШРВЕдЦЖµД1 molЎ¤LЈ1 FeCl3ИЬТє(УГЕЁСОЛбЛб»Ї)ЦРНЁИлSO2ЖшМеЈ¬ИЬТєБўјґ±дОЄємЧШЙ«ЎЈјё·ЦЦУєуЈ¬·ўПЦИЬТєСХЙ«±діЙЗіВМЙ« |
УГМъЗи»ЇјШK3[Fe(CN)6] ИЬТєјмСйІЅЦиўЪєНІЅЦиўЫЛщµГИЬТєЦРµДFe2Ј«Ј¬ЖдПЦПуОЄ______________
(4)ЧЫєПЙПКцКµСйМЅѕї№эіМЈ¬їЙТФ»сµГµДКµСйЅбВЫЈє
ўс.SO2УлFeCl3ИЬТє·ґУ¦ЙъіЙємЧШЙ«ЦРјдІъОп[Fe(HSO3)]2Ј«АлЧУЈ»
ўт.ємЧШЙ«ЦРјдІъОпЧЄ±діЙЗіВМЙ«ИЬТєКЗТ»ёцЅПВэµД№эіМЈ»
ўу.______________________ _______ЎЈ
Ійїґґр°ёєНЅвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com