
【题目】下列对于化合物的叙述中,正确的是
A. 活细胞中含量最多的化合物一般是蛋白质
B. 无机盐主要以化合物质形式存在
C. 脂质中具有良好储能作用的是胆固醇
D. 玉米叶肉细胞中有两种核酸,各含有4种核苷酸
科目:高中化学 来源: 题型:
【题目】(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4 . 考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图),使浆液分离成固体混合物和含铬元素溶液,并回收利用.回答Ⅰ和Ⅱ中的问题.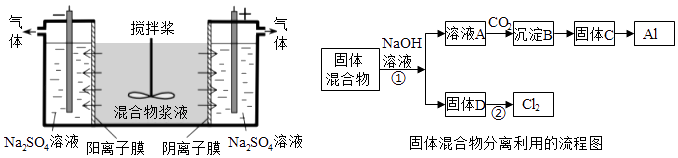
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为 . B→C的反应条件为 , C→Al的制备方法称为 .
(2)该小组探究反应②发生的条件.D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2 . 由此判断影响该反应有效进行的因素有(填序号) .
a.温度 b.Cl﹣的浓度 c.溶液的酸度
(3)0.1mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2xH2O的液态化合物,放热4.28kJ,该反应的热化学方程式为 .
Ⅱ含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42﹣能从浆液中分离出来的原因是 , 分离后含铬元素的粒子是;阴极室生成的物质为(写化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2KMnO4+16HCl═2KCl+5Cl2↑+2MnCl2+8H2O,如图所示是验证氯气性质的微型实验,a、b、c、d、e是浸有相关溶液的滤纸.向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.对实验现象的“解释或结论”正确的是( )

选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>I2 Cl2>Br2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Cl->Fe2+ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双酚A(也称BPA)常用作塑料制品添加剂,其结构简式如图所示.下列关于双酚A的叙述正确的是( ) 
A.双酚A分子的核磁共振谱有4组峰
B.双酚A分子中所有的碳原子可能共平面
C.1mol双酚A最多可与2molBr2反应
D.双酚A与足量H2反应的产物属于芳香醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示化合物的说法不正确的是( ) 
A.该有机物的分子式为C15H18O4
B.1mol该化合物最多可以与2molNaOH反应
C.既可以催化加氢,又可以使酸性KMnO4溶液褪色
D.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家对原子结构的认识顺序正确的是
①道尔顿原子模型 ②卢瑟福原子模型 ③汤姆生原子模型 ④电子云模型
A.①②③④B.④①②③C.④②③①D.①③②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某研究性学习小组为了制取、收集纯净干燥的氯气并探究氯气的性质,他们设计了如图所示的实验装置:
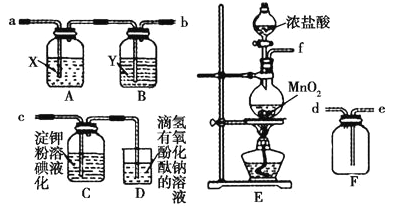
请回答下列问题:
(1)整套实验装置的连接顺序是f接_____接_____接____(填各接口处的字母代号)。
(2)E装置中制取氯气的离子方程式是___________________。
(3)A装置中试剂X是___________________。
(4)C装置中的现象是________,产生此现象的原因是____________(用离子方程式和必要的文字解释)。
II.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设制一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池选择的电解质溶液是______________(填化学式);
(2)正极电极反应的离子方程式是____________________;
(3)若导线上转移电子1mol,则生成银的质量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定量的CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应CO(g)+H2OCO2(g)+H2(g)得到如下三组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衝所需时间/min | |
CO | H2O | CO2 | |||
1 | 500 | 8 | 4 | 3.2 | 4 |
2 | 700 | 4 | 2 | 0.8 | 3 |
3 | 700 | 4 | 2 | 0.8 | 1 |
(1)①下列情况表明反应达到平衡状态的是 (填序号)
A.CO2和H2生成速率相等
B.温度不变时,压强不变
C.生成CO2的速率和生成CO的速率相等
②实验2中,反应达到平衡状态时,CO的转化率为 .
③实验3和实验2相比,改变的条件是 .
(2)①硫化钠溶液具有较强碱性,其原因是(用离子方程式表示).
②欲使0.1mol的Na2S溶液中, ![]() 的值增大,可采取的措施是(填序号)
的值增大,可采取的措施是(填序号)
A.加适量等浓度的NaOH溶液
B.加适量的水
C.通入适量的H2S气体.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。
N2+3H2![]() 2NH3
2NH3
现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生,下列有关说法正确的是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com