
| A. | 因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性高锰酸钾溶液、石蕊试液褪色 | |
| B. | 能使品红溶液褪色的不一定是SO2 | |
| C. | SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同 | |
| D. | SO2和Cl2等物质的量混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好 |
分析 A.依据二氧化硫具有漂白性、还原性、酸性氧化物性质解答;
B.氯水、过氧化钠、活性炭等都具有漂白性;
C.二氧化硫使红墨水褪色体现二氧化硫漂白性、活性炭能使红墨水褪色体现吸附性、漂白粉和过氧化钠使红墨水褪色体现强氧化性;
D.SO2和Cl2这两种气体和水反应生成硫酸、HCl.
解答 解:A.二氧化硫具有漂白性,能够使品红褪色,二氧化硫具有还原性能够使高锰酸钾褪色,二氧化硫为酸性氧化物,与水反应生成亚硫酸,使石蕊变红色,故A错误;
B.能使品红溶液褪色的不一定是SO2,可能是氯水、过氧化钠、活性炭等,故B正确;
C.二氧化硫使红墨水褪色体现二氧化硫漂白性、活性炭能使红墨水褪色体现吸附性、漂白粉和过氧化钠使红墨水褪色体现强氧化性,所以其原理不同,故C错误;
D.SO2和Cl2这两种气体和水反应生成硫酸、HCl,硫酸、盐酸没有漂白性,所以将SO2和Cl2这两种气体同时作用于潮湿的有色布条不一定使其褪色,故D错误;
故选:B.
点评 本题考查物质的漂白性,明确二氧化硫的性质,熟悉次氯酸、过氧化钠、活性炭漂白原理是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | BaCl2 | B. | NaOH | C. | Ba(NO3)2 | D. | Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.7g | B. | 8.1g | C. | 5.4g | D. | 10.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钢铁工业是国家工业的支柱,每年钢铁生锈让国家损失大量资金,请回答钢铁腐蚀与防护过程中的有关问题.
钢铁工业是国家工业的支柱,每年钢铁生锈让国家损失大量资金,请回答钢铁腐蚀与防护过程中的有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
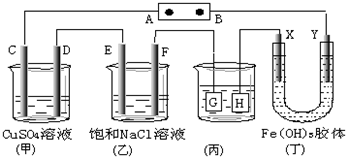
| A. | 若用乙烷、空气燃料电池作电源,电解质为KOH溶液,则B极的电极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| C. | (丁)装置中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 | |
| D. | C、D、E、F电极均有单质生成,其物质的量比为1:1:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用草酸钠标定高锰酸钾溶液的实验中,滴定终点的判断为:当滴入最后一滴高锰酸钾溶液时,溶液由无色变为浅紫色,且半分钟内不褪色 | |
| B. | 探究“影响硫代硫酸钠与稀硫酸反应速率的因素”的实验中,需要用到的计量仪器只需量筒、温度计 | |
| C. | 在溴富集过程中,可在分液漏斗中加入1mL溴水,再向其中加入3mL四氯化碳,振荡,静置、分液,得下层液体 | |
| D. | 在两支试管中分别加1ml无水乙醇和1.5g苯酚固体,再加等量等体积的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com